5 Газовая коррозия – какими особенностями она описывается?
Под воздействием газов металлические поверхности могут разрушаться в том случае, когда имеется высокая температура. Данное явление специалисты именуют газовой коррозией, которая признается самым распространенным вариантом химического ржавления. Известная всем вариация подобного процесса – контакт кислорода и металлической поверхности, которая характеризуется двумя показателями:
- давлением при конкретной температуре диссоциации оксидных паров;
- давлением (парциальным) кислорода.
Если давление кислорода меньше давления диссоциации, появляется чистый металл, если больше – образуется окисел. При равных величинах реакция будет полностью равновесной. Учитывая это, можно без труда рассчитать, при каких температурах возникнет опасность коррозии.
Химическая коррозия протекает с разной скоростью. Конкретная величина последней находится в зависимости от далее приведенных факторов:
Коррозия металлов, особенно ее основная разновидность — электрохимическая, всегда создавала трудности эксплуатации любых металлических изделий, безвременно разрушая их. Простейшие орудия труда (нож, топор, плуг) быстро приходили в негодность во влажной среде. Потребовались многочисленные и длительные исследования химических процессов разрушения, прежде чем были найдены технические решения, приостанавливающие коррозию металлов.
Виды
Коррозия может происходить в присутствии электролитов и неэлектролитов. Поэтому основными видами коррозии металлов по механизму возникновения являются:
- химическая – возникает в отсутствии электролита в сухой или влажной среде;
- электрохимическая – происходит в присутствии электролита.
Химическая коррозия связана с неэлектролитами – веществами, не проводящими электрический ток в растворах или расплавах. К неэлетролитам относятся многие простые неорганические (кислород, водород) и органические (эфир, бензол) вещества.
Химическая коррозия может происходить в присутствии газов (водорода, кислорода, хлора), органических кислот и солей. Молекулы металла соединяются с химическими элементами, и на металлической поверхности возникают плёнки – оксиды, сульфиды, гидриды. Внешне это заметно по изменению цвета. Железо, соединяясь с кислородом, образует Fe2O3 – оксид железа (III) – рыжую ржавчину.
Рис. 2. Оксид железа.
Если в расплаве или в растворе присутствуют вещества, проводящие электрический ток (электролиты), то появляется электрохимическая коррозия. Она возникает в присутствии солей, кислот, щелочей или при соприкосновении поверхностей двух металлов, между которыми находится влажная среда. Из-за разности окислительно-восстановительных потенциалов возникает гальванический элемент – источник электрического тока. Металл выступает в роли анода (восстановителя), электролит – катода (окислителя). Анод, отдавая электроны, окисляется или коррозирует.
Рис. 3. Схема электрохимической коррозии.
Классификация коррозии может проводиться по другим признакам. По очагу поражения коррозия бывает:
- местной;
- сплошной;
- точечной.
Коррозия может происходить в разных средах:
- газовой (безводной);
- атмосферной (влажной);
- жидкостной;
- грунтовой;
- радиационной.
Соль ускоряет процесс ржавления, поэтому корабли быстрее ржавеют в морской, чем в пресной воде.
Что мы узнали?
Коррозия – окисление и разрушение металла под воздействием окружающей среды. Процесс окисления может происходить в присутствии или в отсутствии электролитов. Коррозия, возникающая без воздействия электролитов, называется химической. На поверхности металлов возникают оксиды, гидроксиды, соли. Под действием электролитов возникает электрохимическая коррозия. Окислению подвергается металл, выступающий в роли анода.
-
/5
Вопрос 1 из 5
Что происходит при коррозии?
- Окисление металла и восстановление корозионной среды
- Восстановление металла и окисление корозионной среды
- Окисление металла и коррозионной среды
- Восстановление металла и коррозионной среды
Электрохимическая коррозия
— наиболее распространённый видом разрушения металлов. Примером электрохимической коррозии является, например, разрушение деталей машин, приборов и различных металлических конструкций в почвенных, грунтовых, речных и морских водах, в атмосфере, под пленками влаги, в технических растворах, под действием смазочно-охлаждающих жидкостей и т.д. Как уже было отмечено, электрохимическая коррозия протекает на поверхности металлов под действием электрических токов, то есть происходят окислительно-восстановительные химические реакции, характеризующиеся отдачей электронов и их переносом, так как образуются катодные и анодные участки. Образованию катодов и анодов способствуют химическая неоднородность металлов (примеси и включения), наличие участков остаточной деформации, неоднородность покрывающих металл защитных плёнок и т.д. Наиболее часто в образовании данного вида разрушения металла участвуют не один фактор, а несколько. Когда метал начинает корродировать, он превращается в многоэлектронный гальванический элемент.
Например, рассмотрим что происходит, если медь Cu контактирует с железом Fe в среде электролита. Такая система представляет собой гальванический элемент, где железо — анод («+»), а медь — катод. Железо отдает электроны меди и переходит в раствор в виде ионов. Ионы водорода движутся к меди, где разряжаются. Катод постепенно становится более отрицательным, в конце-концов становится равным потенциалу анода и коррозия замедляется.
Как раз на эту тему можно провести опыт в домашних условиях. Нам потребуется три стакана с раствором поваренной соли (пищевая соль), 3 железных гвоздя, кусочек цинка и медная проволока (без изоляции). Итак, приступим. Первый гвоздь опустите в стакан с раствором соли. Ко второму гвоздю прикрутите медную проволоку, а к третьему — кусочек цинка. Затем опустите каждый гвоздь в свой стакан с раствором соли (их было 3) и оставьте их на 2-3 суток.
Что происходит: все наши гвозди будут иметь следы ржавчины (коррозии). В самом худшем состоянии будет тот гвоздь, который находился в растворе вместе с медной проволокой, а меньше всего корродировал тот, который привязан к цинку! Объяснение: все металлы обладают разной способностью отдавать электроны. Сравнить их в этой способности можно, ознакомившись с рядом напряжений металлов:
Li← K← Rb← Cs← Ba← Ca← Na← Mg← Al← Mn← Cr← Zn← Fe← Cd← Co← Ni← Sn← Pb← H2← Cu← Ag← Hg← Pt← Au
Те металлы, которые в ряду напряжений находятся левее (например Zn — цинк находится левее Fe — железа), легче отдают свои электроны, чем металл справа (например Cu — медь правее Fe — железа). А значит, как только оба металла попадают в электролит (проводник тока- раствор соли), то сразу образуют гальваническую пару. Более активный металл (стоящий левее) заряжается положительно, а менее активный — отрицательно.
Вернёмся к нашему опыту: тоже самое произошло и в наших стаканах с растворами. Железо (Fe) стоит левее, чем медь (Cu), поэтому оно заряжается положительно, при этом быстро окисляясь. В стакане с цинком — цинк (Zn) — более активный, чем железо. Поэтому, пока весь цинк не поржавеет, железо не разрушится (чем часто пользуются в технических целях).
ВОДОРОДНАЯ И ГАЛОГЕНИДНАЯ КОРРОЗИЯ
Водородная коррозия возникает при диффузии водорода в сталь и другие материалы при высоких температурах, что наблюдается, например, в аппаратуре для синтеза аммиака или переработки метана. Она вызывает изменение механических свойств металлов: повышение хрупкости стали, ее расслоение и пузырение. Хрупкое разрушение при водородной коррозии в большей степени характерно для высокоуглеродистой стали, имеющей высокие прочностные показатели, тогда как для мягких сталей типично расслоение и пузырение.
Учитывая, что метан при определенных условиях легко разделяется на углерод и водород, водородная коррозия может возникать в аппаратах и сосудах, работающих под давлением с природными и попутными нефтяными газами. Метан собирается в отдельных пустотах, трещинах, дефектах металла, вызывая внутренние напряжения, из-за которых приходится снижать рабочие нагрузки на детали. В результате в мягких сталях возникают пузыри, и металл расслаивается, а высокопрочные стали при относительно небольших механических нагрузках подвергаются хрупкому разрушению.
Медь, а также некоторые ее сплавы могут быть склонны к водородной коррозии в тех случаях, когда недостаточно глубоко проведено их раскисление в процессе металлургического производства, то есть когда в металле сохранился кислород, например, в виде закиси меди Cu2O. Этот оксид образует отдельную фазу в металле, а проникающий в металл водород, химически взаимодействуя с ним, восстанавливает его. Образуется водяной пар, который при высокой температуре может быть причиной возникновения хрупкости меди.
Все это следует принимать во внимание при использовании порошковых материалов для изготовления центробежных колес и управляющих аппаратов ЭЦН, которые во многих случаях не выдерживают условий эксплуатации, и это связано как раз с возникновением хрупкости меди, которая используется в порошковых ступенях как связующий материал. В результате ухудшается работа направляющих аппаратов и рабочих колес, в них возникают зоны, которые промываются потоком пластовой жидкости
Некоторые металлы, например титан, способны поглощать (абсорбировать) большие количества кислорода при высокой температуре. Если такой металл оказывается затем в контакте с водородом, то также может наблюдаться водородная коррозия, снижающая его прочность
Учитывая, что многие аппараты, работающие под давлением, изготовлены из стали типа 09Х13Н2Т, где содержится до 1,5% титана, следует обязательно принимать во внимание вопросы температурного напряжения и, соответственно, контакта со свободным водородом и кислородом титана, который используется для изготовления этих видов оборудования
Галогенидная коррозия представляет собой процесс коррозии металлов в хлористом водороде, хлоре, фторе, броме, йоде с образованием галогенидов. Обычно при низких температурах большинство металлов слабо взаимодействует с такими веществами, но при температурах 200–300°С происходит самоускорение этих реакций, и некоторые металлы буквально «сгорают». Это нужно помнить при разработке месторождений, в пластовой воде которых содержится значительное количество галогенов. При воздействии на пласт термическими способами, при откачке жидкости с помощью центробежных насосов, температура может достигать величины, при которой возникает галогенидная коррозия.
Электрохимическая коррозия
Для понимания сущности электрохимической коррозии напомним работу гальванических элементов.
Если погрузить в серную кислоту цинковую и медную пластинки и замкнуть их через гальванометр, то гальванометр будет. показывать присутствие в цепи электрического тока. Гальванический элемент, как говорят, будет «работать». В процессе работы такого элемента с цинковой пластинки в раствор будут переходить ионы цинка Zn+, и она будет растворяться, заряжаясь прй этом отрицательно, а пластинка меди остаётся неизменённой, она будет служить местом, где нейтрализуются положительно заря>кенные ионы раствора (ионы водорода).
Электрохимическая коррозия по существу напоминает работу гальванических элементов, ибо любой металл не является однородным. Различные включения в металл могут служить и служат в качестве электродов. Одни из них являются анодными участками, другие — катодными. Анодные участки будут растворяться, на катодных участках будет выделяться водород.
Было уже давно замечено, что чем чище металл, тем труднее он растворяется в кислоте. Таким образом, растворение металла в кислоте можно рассматривать как результат работы колоссального количества микроскопических гальванических элементов, у которых катодами являются посторонние примеси, находящиеся в металле, анодами — сам металл.
Опыт показывает; что по мере растворения металла скорость его разрушения увеличивается. Это объясняется тем, что число катодных участков по мере растворения металла возрастает. Разрушение металла вызывают не только примеси, но и неодинаковость строения различных участков его. Так, например, разность потенциалов, т. е. возможность образования гальванических элементов, наблюдается между ребром и гранью одного и того же кристалла какого-либо металла. Известно, что различно обработанная поверхность металла также может создавать гальваническую пару.
Электрохимическая коррозия наблюдается в том случае, когда имеется соединение металлов, находящихся в ряду напряжений на значительном расстоянии. Так, например, если из листового железа при помощи медных или латунных заклёпок изготовляется
металлическая ёмкость, то медная заклёпка будет играть роль катода, а железный лист станет анодом и, следовательно, будет разрушаться.
Интенсивность коррозии принято иногда выражать потерей веса металлического образца за единицу времени или количеством
водорода, выделяющегося при растворении металла. Водородный (объёмный) метод пригоден только тогда, когда коррозия протекает с выделением водорода; он более точен, чем гравиметрический (весовой), так как объём газа можно измерить с точностью до десятых долей куб. сантиметра.
Однако оба эти метода не дают правильного представления о последствиях коррозии: в случае неравномерной коррозии потеря в весе или количество выделившегося. водорода дают лишь представление о потере металла, но не о результатах коррозионного павреждения изделия.
Следующая страница: Защита металлов от коррозии
| → Главная → Энциклопедия стали → Химическая и электрохимическая коррозия металлов |
Механизм действия электрохимической коррозии
Электрохимическая коррозия — это процесс разрушения материала в результате его взаимодействия с окружающей средой под воздействием электрического тока. Главным механизмом действия электрохимической коррозии является электрохимическая реакция, которая возникает на поверхности материала.
Когда металл контактирует с окружающими средами, возникают разностные потенциалы между различными участками его поверхности. Фактически, металл является электрической системой со своей внутренней электрической нейтральностью. Это означает, что на металлической поверхности существуют области, имеющие разные потенциалы относительно окружающей среды.
Вследствие разности потенциалов между различными участками поверхности возникают электрические токи, которые приводят к электрохимическим реакциям. При коррозии металла ток ионов между различными областями поверхности создает потенциал коррозии, который способствует разрушению материала.
Механизм действия электрохимической коррозии можно представить следующим образом:
- Вследствие контакта металла с окружающей средой, на его поверхности образуется анодная область и катодная область.
- В анодной области происходит окисление металла, при котором электроны переходят на ионный уровень, вызывая образование положительно заряженных ионов металла.
- Положительно заряженные ионы металла перемещаются к катодной области.
- В катодной области происходит редукция, при которой ионы металла принимают электроны от окружающей среды и переходят на нейтральный уровень.
- Таким образом, в результате электрохимических реакций, проходящих в анодных и катодных областях, металл подвергается коррозии.
Механизм действия электрохимической коррозии имеет большое значение при изучении и предотвращении коррозионных процессов, так как позволяет понять основные причины и факторы, влияющие на коррозию материалов.
Химическая коррозия
Как известно, даже в сухом воздухе при обычной температуре металлы и сплавы изменяются. Блестящая глянцевитая поверхность металла тускнеет, становится матовой. Это объясняется тем, что металл покрывается тончайшей плёнкой окисла — продуктов взаимодействия металла и кислорода воздуха. Повышение температуры ускоряет этот процесс. Если образующаяся на поверхности металла окисная плёнка плотная, как, например, у алюминия или цинка, то она предохраняет металл от дальнейшего окисления и играет своего рода защитную роль для него. На других металлах, в частности на железе, поверхностная плёнка имеет поры, через которые проникает кислород воздуха, вследствие чего такая плёнка не препятствует дальнейшему разрушению металла.
Образование плёнок на поверхности металлов связано с влиянием не только кислорода, но и других газов, находящихся в воздухе. С металлом реагирует сернистый газ, углекислый газ и др. Эти газы при совместном воздействии водяных паров воздуха очень быстро разрушают металл.
Некоторые минеральные кислоты, как, например, серная и азотная, так же как и кислород воздуха, при взаимодействии с металлом образуют на его поверхности плотную окисную плёнку. Так, например, если пластинку железа с хорошо очищенной поверхностью поместить в концентрированную азотную кислоту, то на поверхности возникает прочная окисная плёнка, предохраняющая железо от его дальнейшего растворения. В этом случае говорят, что азотная кислота пассивирует железо. Однако если такую же пластинку, предварительно не обработанную концентрированной азотной кислотой, опустить в ту же кислоту, но разбавленную, она быстро будет разрушаться. Точно так же концентрированная серная кислота пассивирует поверхность железа, предохраняя его от дальнейшего разрушения.
Химическая коррозия особенно быстро протекает в присутствии влаги, углекислого газа и кислорода воздуха. На поверхности железных изделий в этих случаях образуется слой ржавчины. Оксид железа покрывает его хрупким и пористым слоем. Поэтому такой окисный слой не предохраняет металл от дальнейшего ржавления. Химическая коррозия, особенно газовая, приносит громадный ущерб народному хозяйству. Не меньший вред почти всем отраслям народного хозяйства причиняет и электрохимичесиая коррозия.
Коррозия меди в воде
Скорость коррозии меди в воде во многом зависит от наличия на поверхности оксидных пленок.
В быстро движущихся водных растворах и воде медь подвергается такому виду разрушения, как ударная коррозия. Скорость протекания ударной коррозии меди сильно зависит от количества растворенного кислорода. Если вода сильно аэрирована – ударная коррозия меди протекает интенсивно, если же обескислорожена – разрушение незначительно. Коррозия меди в аэрированной воде усиливается с уменьшением рН, увеличением концентрации ионов хлора. Скорость коррозии меди в воде зависит от климатической зоны. В тропиках скорость разрушения несколько выше.
Особенностью меди, омываемой морской водой, можно считать то, что она является одним из немногих металлов, которые не подвержены обрастанию микроорганизмами. Ионы меди для них губительны.
С чистой меди очень часто изготавливают трубопроводы для подачи в дома воды. Они надежны, служат очень долгое время. При наличии в воде растворенной угольной и других кислот медь понемногу корродирует, а продукты коррозии меди окрашивают сантехническое оборудование. Если вода, проходящая через медные трубы контактирует с железом, алюминием или оцинкованной сталью – то коррозию этих металлов значительно усиливается. Ионы меди осаждаются на поверхности этих металлов, образуя коррозионные гальванические элементы.
Чтоб исключить вредное влияние воды с медных труб на другие металлы используют луженую медь. Внутреннюю часть медного трубопровода покрывают оловом. Оловянное покрытие должно быть безпористым, во избежание возникновения гальванического элемента (олово по отношению к меди является катодом).
Электрохимическая коррозия – это самый распространенный вид повреждения, поражающий металлы. Расскажем о методах анодной защиты металлов, отличиях от химической коррозии.
Больше всего металлы боятся коррозии. Она способна привести в негодность самые прочные конструкции. Огромные мосты, линии электропередач, километровые трубопроводы становятся беспомощными перед разрушающим процессом. Чтобы повреждения не допустить, металл защищают
Но важно понимать, что бывает несколько видов окисления. Электрохимическая коррозия, химическая или газовая – все они похожи по следствиям, но эффективными методами защиты от каждого вида будут свои индивидуальные мероприятия, зависящие от многих факторов
Коррозия электрохимического плана наиболее часто поражает металлы. Это связано с тем, что они, как правило, неустойчивы термодинамически в среде, которая их окружает, а последняя чаще представляет обычный электролит, то есть проводник. Поэтому за счет металла коррозионная среда стремится к восстановлению путем переноса частиц через электрический ток.
Протекторная защита от электрохимической коррозии
Как упоминалось выше, чем больше потенциал металла, тем быстрее происходит электрохимическая коррозия. Значит, снижая электрический потенциал, можно добиться наступления момента, когда процесс окисления станет невозможным. На этом принципе основана протекторная или, другими словами, электрохимическая защита металлических конструкций, газопроводов, корпусов морских судов. Берется такой металл, который ведет себя активнее, нежели основной защищаемый, и соединяется с последним токопроводящим проводником. Получается, что уже этот анод вступает в реакцию с коррозионной средой, а основной металл остается невредимым.
Основные случаи, когда применение протекторной защиты будет оправдано:
- Недостаточно средств на проведение более дорогостоящих защитных мероприятий.
- Если защитой нужно обеспечить конструкции из металла небольших габаритов.
- Когда трубопроводы имеют дополнительную поверхностную изоляцию.
Такую защиту от электрохимической коррозии, как протекторная, применяют, в основном, к разным маркам стали. Здесь уместным будет использование протекторов на основе кадмия, алюминия, магния, хрома, цинка, но используется не чистый элемент, а сплавы.
Цинковые протекторы
- до 0.15% кадмия при минимально возможном процентном соотношении в 0.025%;
- до 0.5% алюминия;
- примеси железа, свинца и меди, общей суммой не превышающие 0.005%.
Наиболее эффективное применение цинка выявлено в морской воде, где с помощью таких протекторов успешно работает защита, например, газовых или нефтяных магистралей. Плюс цинка еще в том, что он допустим к использованию со взрывоопасными веществами. Когда происходит растворение анода, не наблюдается выделения загрязняющих веществ, которые могут навредить экологии.
Применение цинковых протекторов в водоемах, где вода имеет пресный состав либо в грунте под землей сопровождается быстрым образованием на поверхности протектора таких соединений, как оксиды и гидроксиды, которые приводят к торможению электрохимического процесса окисления анода, и фактически прекращается защита основного металла от электрохимической коррозии.
Установка цинкового протектора на днище корабля:
Магниевые протекторы
В чистом виде магниевые протекторы нецелесообразно применять, что объясняется быстрым ржавлением этого металла. Поэтому коррозионные защитники на базе магния, кроме него, имеют:
- максимум 5%, минимум 2% цинка;
- максимум 7%, минимум 5% алюминия;
- небольшое содержание меди, никеля и свинца, не более десятых долей процента.
Протекторы из магния хороши, когда среда, в которой они применяются, имеет pH не выше 10.5, что соответствует грунтам обычного характера, водным объектам со слабосоленой акваторией либо попросту пресной воде. Для защиты подходят любые трубопроводы и металлоконструкции, находящиеся в описанных выше условиях. Применение магния в агрессивных соленых растворах сопровождается быстрым образованием плохо растворимой пленки на его поверхности.
Алюминиевые протекторы
Целевое назначение протекторов из алюминия – работать в качестве защиты от электрохимической коррозии в средах с водой проточной с соленым составом, например, в прибрежных морских водах. В составе сплава протектора из алюминия имеются:
- примеси индия, кадмия, кремния не более 0.02%;
- цинка – до 8%;
- магния – до 5%.
Благодаря этим дополнительным металлам нет возможности появления на протекторе жесткой, задерживающей растворение пленки. Допустимо применять алюминиевый протектор и в средах, подходящих для магниевого протектора.
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3,эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
ХИМИЧЕСКАЯ КОРРОЗИЯ
По механизму протекания процесса различают химическую и электрохимическую коррозию. Химическая коррозия представляет собой взаимодействие поверхности металла с коррозионноактивной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
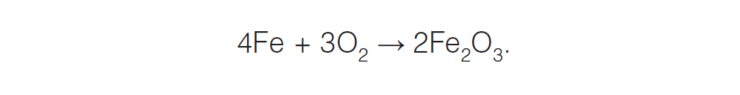
Общая химическая коррозия может протекать как компонентно-избирательная или структурно-избирательная, а локальная коррозия может быть межкристаллитной или носить язвенный характер (такой может быть ванадиевая коррозия).
По природе коррозионной среды различают коррозию в кислородсодержащих или серосодержащих газах, водородную, ванадиевую, галогенидную коррозию, коррозию в расплавах серы и других неметаллах. Эти виды коррозии проявляются в случае, если коррозионная среда не является электропроводной, то есть когда металл соприкасается с газами при высоких температурах и конденсация влаги на поверхности металла исключается. Поэтому при подборе материалов, пригодных для эксплуатации в условиях газовой коррозии, следует сочетать их устойчивость к окислению (жаростойкость) с высокой прочностью при повышенных температурах (жаропрочность).
Так, если речь идет об обработке черных металлов при изготовлении тех или иных прокатных изделий, то часто на основном металле появляется несколько слоев окалины, имеющих разное количество кислорода, который диффундирует и соединяется с основным металлом.
При кислородной коррозии стали происходит ее обезуглероживание. Углерод в стали находится в виде цементита (Fе3C), который образуется в процессе термообработки и обеспечивает высокую прочность материала. Под воздействием кислорода цементит окисляется, и сталь теряет свои прочностные свойства в поверхностных слоях.
В чугуне углерод содержится не только в виде цементита, но и в форме пластинчатого графита, который располагается по границам зерен металла, где происходит наиболее интенсивная диффузия кислорода. Окислению подвергаются, соответственно, участки металла, расположенные на границе зерен. Поскольку продукты окисления имеют больший объем, чем металл, из которого они образовались, происходит увеличение объема металла — явление, известное как «рост чугуна».
В связи с этим можно вспомнить, как в начале 1990-х годов отечественные заводы стали изготавливать нирезист (никелевый чугун), не представляя, к чему может привести эксплуатация изделий из него в условиях низких температур, когда происходит диффундирование кислорода в шаровидный графит. В итоге насосные установки, ступени которых были изготовлены из нирезиста и пролежавшие какое-то время на открытом воздухе в Западной Сибири, оказались непригодными для эксплуатации из-за увеличившегося объема металла.






























