В каком направлении протекают
При записи обратимых реакций, которые протекают в прямом и обратном направлении, принято использовать знак обратимости «» вместо знака «=».
Факторы, оказывающие влияние на смещение равновесия
Когда химическая система находятся в состоянии равновесия, на положение равновесие могут воздействовать несколько основных факторов:
- температура;
- давление;
- концентрация реагентов или продуктов.
Для химических реакций характерен тепловой эффект — выделение или поглощения определенного количества теплоты. Если прямая реакция сопровождается выделением теплоты (является экзотермической, обладает положительным тепловым эффектиом, +Q), то обратная реакция протекает с поглощением теплоты (является эндотермической, обладает отрицательным тепловым эффектом, -Q). При повышении температуры в системе равновесие сместится так, чтобы это повышение компенсировать. Если реакция экзотермическая, то повышение температуры компенсировать не получится. В результате, при повышении температуры равновесие в системе смещается в сторону поглощения теплоты, то есть в сторону эндотермической реакции (-Q). Когда температура понижается, равновесие в системе смещается в сторону экзотермической реакции (+Q).
Если равновесные реакции протекают при наличии хотя бы одного из веществ в газовой фазе, на равновесие также оказывает значительное влияние изменение давления в системе. Когда давление повышается, химическая система старается компенсировать это воздействие. При этом увеличивается скорость реакции, в которой количество газообразных веществ уменьшается. Если давление понижается, система увеличивает скорость реакции, в которой образуется больше молекул газообразных веществ. В результате, при увеличении давления равновесие смещается в сторону уменьшения числа молекул газов, при уменьшении давления — в сторону увеличения количества молекул газообразных веществ.
Изменить равновесие в химических системах можно с помощью изменения концентрации реагирующих веществ и продуктов. Если концентрация реагентов увеличивается, система старается их израсходовать, ускоряя прямую реакцию. В том случае, когда понижается концентрация реагентов, система стремится к их накоплению путем увеличения скорости обратной реакции. В процессе повышении концентрации продуктов система пытается их также израсходовать, что можно наблюдать по ускорению обратной реакции. При понижении концентрации продуктов химическая система увеличивает скорость их образования, то есть скорость прямой реакции.
При увеличении скорости прямой реакции в химической системе можно наблюдать смещение равновесия вправо, то есть в сторону формирования продуктов и расходования реагентов. Если увеличивается скорость обратной реакции, говорят о смещении равновесия в левую сторону, то есть в сторону расходования продуктов и увеличения концентрации реагентов.
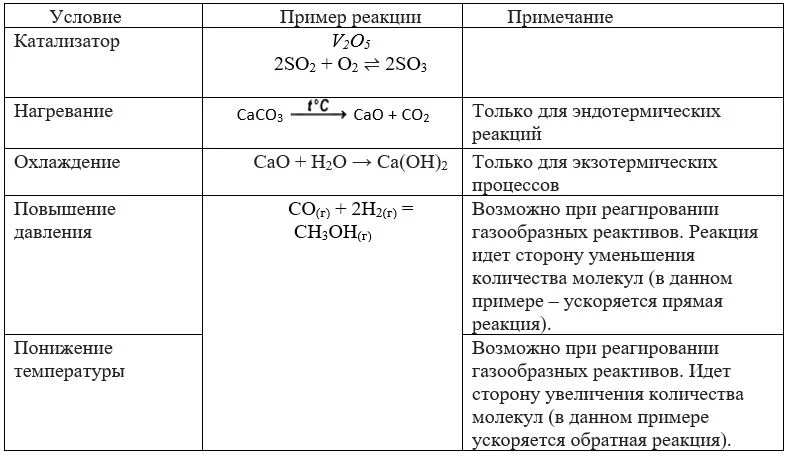
В качестве примера смещения системы можно рассмотреть реакцию получения аммиака:
В данном случае, если давление повышается, то увеличивается скорость реакции, в которой формируется меньшее количество молекул газов, то есть прямой реакции (число молекул газов-реагентов равно 4, число молекул газов в продуктах равно 2). В процессе повышения давления равновесие смещается вправо, в сторону продуктов. Если температура повышается, можно наблюдать смещение равновесия в сторону эндотермической реакции, то есть влево, в сторону реагентов. При увеличении концентрации азота или водорода равновесие смещается в сторону их расходования, то есть вправо, в сторону продуктов.
Идеальное равновесие
| Что выбирает химия – равновесие или хаос? На самом деле, химия не любит равновесие, баланс и порядок, она топит за хаос и смещение равновесия.Однако иногда возникает такая ситуация, когда в единицу времени (секунду/минуту) в единице объема или на единицу поверхности образуется одинаковое количество и продуктов, и реагентов.Запомним: когда продуктов и реагентов одинаковое количество, наступает химическое равновесие. |
Давайте ненадолго вернемся в окружающий нас мир. Наша человеческая природа тоже постоянно стремится к хаосу: нам проще оставить мытьё посуды на потом, чем помыть сразу, нам не хочется после учебы сразу пойти и постирать все вещи или сложить их аккуратно в шкаф. Они чаще всего либо валяются на диване, либо висят на стуле и так далее. Но иногда к нам домой приходят гости или друзья, мы не хотим, чтобы они увидели бардак и поэтому начинаем убираться. И на какое-то время мы говорим “стоп” хаосу и “привет” равновесию и порядку. Замечаете сходство? В химии точно так же!
| Какая связь между химическим равновесием и весами?Чтобы легче запомнить правило химического равновесия, возьмем образ весов. Если чаши наполнены продуктами и реагентами равномерно, весы будут идеально прямы. Так и визуализируйте, когда надо вспомнить. |

Факторы, влияющие на направление химической реакции
Направление химической реакции определяется рядом факторов, которые взаимодействуют между собой
Важно учитывать эти факторы, чтобы понять, какие вещества будут образованы в конечном итоге реакции и в каких количествах
1. Энергетический баланс реакции
Энергетический баланс реакции может быть эндотермическим или экзотермическим. В эндотермической реакции энергия поглощается, а в экзотермической – выделяется. Одним из факторов, влияющих на направление химической реакции, является энергия активации – минимальная энергия, необходимая для начала реакции.
2. Концентрация веществ
Концентрация веществ в реакционной среде также оказывает влияние на направление реакции. По принципу Ле-Шателье, изменение концентрации одного из реагентов или продуктов будет приводить к изменению равновесия и перемещению его в направлении, уменьшающем концентрацию данного компонента.
3. Давление и объем реакционной среды
Давление и объем реакционной среды могут влиять на направление реакции в случае, если реакция сопровождается изменением объема газа. По принципу Ле-Шателье, если давление или объем изменяются, реакция смещается в направлении, приводящем к уменьшению числа молекул газа.
4. Температура
Температура также играет важную роль при определении направления реакции. В большинстве случаев повышение температуры приводит к увеличению скорости реакции, однако в некоторых реакциях повышение температуры может привести к изменению направления реакции.
5. Наличие катализаторов
Катализаторы могут изменить скорость реакции, но они не влияют на направление химической реакции. Они снижают энергию активации реакции, увеличивая количество частиц с достаточной энергией для реакции, но не влияют на термодинамические свойства реакции.
В заключение, направление химической реакции определяется взаимодействием ряда факторов, таких как энергетический баланс, концентрация веществ, давление и объем реакционной среды, температура, и наличие катализаторов. Понимание этих факторов позволяет более точно предсказывать результаты химических реакций и контролировать их процесс.
Химия — это просто
- Популярно о химии
-
· Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
- Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
-
· Виды химических реакций
· Уравнения химических реакций
· Классификации химических реакций
· Баланс химических реакций
· Химическое равновесие
· Скорость химических реакций
· Окислительно-восстановительные реакции
· Составление уравнений ОВР
· Тепловой эффект реакции
· Закон Гесса
· Электрохимические элементы
· Кислоты и основания
· Сильные кислоты и основания
· Слабые кислоты и основания
· Кислотно-основные реакции
· Индикаторы
· Водородный показатель pH - НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ
Особенности импульсных реакций и их направление
Импульсные реакции представляют собой реакции, которые происходят в крайне короткие промежутки времени. Во время таких реакций происходит высвобождение большого количества энергии, что может привести к различным физическим и химическим процессам.
Один из важных аспектов импульсных реакций — их направление. Направление реакции определяется тем, в какую сторону идет энергия и материалы во время реакции. Обычно направление реакции определяется исходя из закона сохранения энергии и закона сохранения массы.
Например, взрывы являются примером импульсных реакций. Во время взрыва происходит высвобождение большого количества энергии, и продукты взрыва распространяются в окружающем пространстве. Направление взрыва определяется взаимодействием частиц вещества и тем, какая энергия идет в ту или иную сторону.
Другим примером импульсных реакций являются быстрые химические реакции. Они происходят настолько быстро, что наблюдать их в реальном времени очень сложно. Направление таких реакций зависит от типа реагентов и условий их взаимодействия. Некоторые реакции могут протекать только в одно направление, в то время как другие могут быть обратимыми, то есть могут протекать в обе стороны.
Импульсные реакции и их направление имеют важное значение для многих областей науки и техники, таких как взрывная и ракетно-космическая техника, радиоэлектроника, химическая промышленность и многие другие. Изучение этих процессов помогает разрабатывать новые технологии и улучшать существующие
| Важные моменты | Описание |
|---|---|
| Время реакции | Импульсные реакции происходят в крайне короткие промежутки времени. |
| Высвобождение энергии | Во время импульсных реакций происходит высвобождение большого количества энергии. |
| Направление реакции | Направление реакции определяется взаимодействием частиц вещества и условиями их взаимодействия. |
| Применение | Импульсные реакции находят применение в различных областях науки и техники. |
Основные понятия
Под химической реакцией понимают процесс превращения одних веществ в другие. При этом, происходит передача электронов или образование новых связей. Каждое химическое взаимодействие характеризуется специфическими параметрами, характеризующими сами реактивы, условия проведения и химические преобразования. От всех этих факторов зависит внешний вид реакционной массы.
- Вещества, которые вступают в химическую реакцию, называются исходными, а образующие в результате нее – продукты.
- Исходя из преобразований молекул выделяют типы химических реакций: соединение, расщепление, замещение, обмен. Есть более сложные варианты: полимеризация, комплексообразование, перенос.
- В любой реакции происходит изменение энергетических состояний молекул. В одних случаях требуется затрата энергии на разрыв молекулярных связей – эндотермические реакции, в других – энергия выделяется сама из-за ее высвобождения – экзотермические процессы.
- Вещества могут находиться в разных агрегатных состояниях – жидком, твердом, газообразном. Также, в процессе химического взаимодействия может происходить смена агрегатного состояния.
Все эти факторы формируют параметры химического процесса: признаки, скорость, обратимость и т.д.
Обратимость химических реакций
Химические процессы могут протекать как в одну, так и в обе стороны. Последние называются обратимыми.
Чаще всего, в таких реакциях устанавливается равновесие – это значит, она идет с одинаковой скоростью в обоих направлениях. Зафиксировать тот или иной продукт становится сложно. В основном, направление процесса изменяется при повышении концентрации одного из реактивов.
Практически любая реакция, в которой не образуется окончательный продукт – газ, осадок или вода – являются обратимыми, так как ионы в растворе соединяются как в исходные молекулы, так и в продукты реакции с одинаковой скоростью. Зафиксировать образование одного из продуктов реакции не представляется возможным.
Обратимым реакциям можно задать определенное направление, используя катализаторы:
Например, в реакции получения аммиака из водорода и азота – 3H2 + N2 ⇌ 2NH3 –в качестве катализатора используют порошок железа, смещающего равновесие в сторону прямой реакции.
Для разных обратимых процессов характерны специфические катализаторы, ускоряющие прямой или обратный процесс.
Таблица. Условия протекания обратимых реакций
Изменение объема смеси взаимодействующих веществ не влияет на скорость, так как увеличение количества молекул не ускоряет их движение. А вот повышение чистоты реагентов может увеличить скорость реакции, так как увеличит вероятность столкновения нужных реагентов. Правда, в ряде случаев (серная и азотная кислота) изменение концентрации приводит к изменению состава продуктов.
Иногда, для течения реакции в определенно направлении нужно отводить продукт ее протекания: собирать осадок, газ или осаждать один из растворимых продуктов.
Таким образом, считается, что реакция идет, если мы можем увидеть или проверить с помощью специальных реактивов (индикаторов) образование новых продуктов. Если реакция идет в обоих направлениях, то она считается обратимой. В таком случае, ускорить ее в определенном направлении можно изменением условий (давление, температура, катализатор) или отведением одного из продуктов реакции.
Реакции двойного замещения
В реакциях двойного замещения происходит замещение уже двух электронов. Такие реакции еще называют реакциями обмена. Такие реакции проходят в растворе с образованием:
- нерастворимого твердого вещества (реакции осаждения);
- воды (реакции нейтрализации).
Реакции осаждения
При смешивании раствора нитрата серебра (соль) с раствором хлорида натрия образуется хлорид серебра:
Молекулярное уравнение: KCl(р-р) + AgNO3 (p-p) → AgCl(т) + KNO3 (p-p)
Ионное уравнение: K+ + Cl- + Ag+ + NO3— → AgCl(т) + K+ + NO3—
Молекулярно-ионное уравнение:
Cl- + Ag+ → AgCl(т)
Если соединение растворимое, оно будет находиться в растворе в ионном виде. Если соединение нерастворимое, оно будет осаждаться, образовывая твердое вещество.
Растворимые ионные соединения:
|
Нерастворимые ионные соединения:
|
Реакции нейтрализации
Это реакции взаимодействия кислот и оснований, в результате которых образуются молекулы воды.
Например, реакция смешивания раствора серной кислоты и раствора гидроксида натрия (щелока):
Молекулярное уравнение:
H2SO4 (p-p) + 2NaOH(p-p) → Na2SO4 (p-p) + 2H2O(ж)
Ионное уравнение:
2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O(ж)
Молекулярно-ионное уравнение:2H+ + 2OH- → 2H2O(ж) или H+ + OH- → H2O(ж)
Влияние на равновесную систему
С химическим равновесием разобрались, теперь двигаемся дальше.
Что будет, если на нашу идеальную равновесную систему оказать какое-либо влияние?
Произойдет смещение, то есть сдвиг равновесия – нарушение химического равновесия за счет преобладания скорости прямой или обратной реакции.
На химическое равновесие будет влиять несколько факторов:
- температура,
- давление и объем,
- концентрация реагента или продукта.
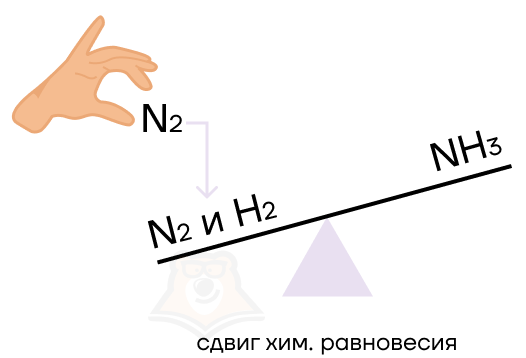

Как же определить, как именно какое-то воздействие повлияет на химическое равновесие? Здесь нам поможет волшебное правило Ле Шателье. Согласно ему при действии на систему, которая находится в равновесии, равновесие смещается в ту сторону, которая будет ослаблять воздействие.
То есть система, как капризный ребёнок, всё делает наоборот. Действие, которое будут оказывать на него, будет вызывать кучу криков и споров, то есть противодействие.
Теперь давайте углубимся в факторы, которые влияют на равновесие
Важно понимать, что может вывести систему из себя.
- Температура
Мы уже знаем, что по тепловому эффекту реакции делят на экзо- и эндотермические.
Подробнее об этом можно прочитать в следующей статье: «Электролитическая диссоциация электролитов в водных растворах».
Так как согласно правилу Ле Шателье система нам всегда противодействует, то:
- при повышении температуры (+) равновесие будет смещаться в сторону эндотермической реакции (-);
- при понижении температуры (-) – в сторону экзотермической реакции (+).
Подробнее про типы химических реакций можно прочитать в статье «Химические реакции по тепловому эффекту».
Рассмотрим теперь это на примере:

При увеличении температуры, равновесие такой реакции будет смещаться в сторону обратной реакции, так как именно в ту сторону будет идти эндотермическая реакция.
А при уменьшении температуры, равновесие сместится в сторону прямой реакции, так как там происходит экзотермическая реакция.
- Концентрация
Опять же вспоминаем, что система – вредный ребенок, который всё делает наоборот. Поэтому при добавлении какого-либо вещества (повышении концентрации) она старается поскорее его израсходовать, а при уменьшении концентрации (разбавлении) наоборот – экономить и забирать это вещество себе.
То есть при повышении концентрации реагентов и понижении концентрации продуктов происходит сдвиг равновесия в сторону продуктов, а при понижении концентрации реагентов и повышении концентрации продуктов равновесием смещается в сторону реагентов.
Рассмотрим теперь это на примере:

Что произойдет при увеличении концентрации азотистой кислоты?
Увеличится концентрация продукта, следовательно равновесие сместится в сторону реагентов.
Важно! Добавление твердых нерастворимых веществ не оказывает влияния на смещение равновесия. Однако при добавлении твердых растворимых веществ смещение может происходить, так как в воде растворимые вещества диссоциируют на ионы, то есть распадаются на заряженные частицы
Однако при добавлении твердых растворимых веществ смещение может происходить, так как в воде растворимые вещества диссоциируют на ионы, то есть распадаются на заряженные частицы.
Например:

- Давление (только для газов)
Правило “сделай наоборот” работает и для этого фактора. При увеличении давления равновесие смещается в сторону меньших объемов газов, а при уменьшении давления – в сторону больших объемов газов.
Как посчитать эти объемы газов?
Легко! Просто считаем сколько всего моль газов и в продуктах и в реагентах, где количество вещества больше, там и объем больше!
Рассмотрим на примере:

Что произойдёт при увеличении давления?
Считаем газы (в реагентах 2 моль, в продуктах 0 моль), поэтому равновесие сместится в сторону продуктов.
Важно! Давление и объем обратно пропорциональны, поэтому увеличение давления = уменьшение объема, а уменьшение давления = увеличение объема
| Может ли “такси” сместить химическое равновесие?Какое такси? Мы говорим о катализаторе, который разгоняет скорость химической реакции. Он и является “такси” в химии.Подробнее про это можно почитать в статье: «Скорость химической реакции».Так вот, несмотря на то, что катализатор влияет на скорость реакции, на смещение равновесия он влиять не будет! Так что его “услуги” тут не будут работать. |
Признаки химической реакции
Признак химической реакции – видимое изменение в реакционной смеси, по которому мы можем определить, что реакция прошла.
Такие признаки могут быть видны сразу:
- Выделение газа;
- Выпадение осадка;
- Растворение осадка
- Изменение цвета;
- Свечение;
- Появление специфического запаха
Иногда, констатировать процесс реакции можно только с использованием дополнительных реактивов:
- Изменение кислотности раствора;
- Образование продукта, вступающего в специфическую реакцию с видимыми изменениями характеристик реакционной смеси.
Выделение газа
Выделение газа происходит при образовании газообразного продукта или слабого электролита, распадающегося с выделением газа. Основной сложностью является идентификация образовавшегося продукта. Для каждого вещества существуют специфические признаки, идентифицирующие его.
Таблица. Газ и методы его определения


Выпадение осадка
Запомнить в какой реакции произойдет выпадение осадка не нужно. Это можно определить по таблице растворимости.

Осадки разных соединений отличаются по цвету и размеру кристаллов. Многие соединения имеют белый цвет:
- Карбонат кальция (растворим в кислотах);
- Сульфат бария (мелкокристаллический, нерастворим в кислотах);
- Гидроксид магния (аморфный);
- Гидроксид алюминия (студенистый);
- Гидроксид цинка (растворим в избытке щелочи);
- Фосфат кальция;
- Кремниевая кислота (коллоидная масса).
Ряд солей имеют желтый цвет:
- Бромид серебра (светло-желтый);
- Сульфат кадмия;
- Фосфат серебра.
Ярко-красное окрашивание характерно для гесацианоферрата калия, а гексацианоферрат железа – синий.
Сульфаты большинства металлов черного цвета.
Свечение
Люминесценция – редки признак химической реакции. Это часто наблюдается в живой природе у растений (в процессе фотосинтеза) и животных (светлячки).
К химии это можно наблюдать при использовании специального вещества – люминола. Такие реакции широко распространены в криминалистике, так как люминол очень чувствителен к органическим веществам. Причем, по цвету и степени свечения можно определить примерный состав и время оставления обнаруженного следа.
Появление специфического запаха
Запах можно почувствовать при образовании газов. Основные газы? из них – аммиак и оксид серы (IV). Такие вещества ядовиты, поэтому их идентификация без соблюдения техники безопасности может привести к отравлению и ожогу слизистой носа.
Изменение кислотности раствора
В реакции может происходить образование кислот, оснований или солей. Изменение кислотности можно определить добавив индикатор. В химии используются три основные индикатора: фенолфталеин, метилоранж, лакмус.
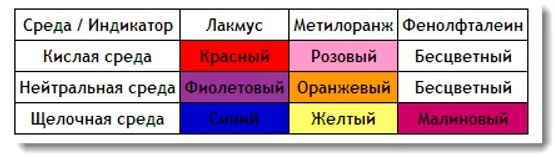
Для определения щелочи лучше всего использовать фенолфталеин, так как он меняет цвет только в этой среде. Самым неудобным индикатором для определения кислотности среды является метилоранж, так как различить в реальности оранжевый и желтый бывает сложно.
Кроме растворов индикаторов можно использовать индикаторную бумагу: она может быть пропитана одним индикатором или всеми одновременно. Последняя называется универсальной. С помощью такой бумаги можно определить не только среду – кислая, щелочная или нейтральная, но и более точное значение pH. Такая бумага очень чувствительна. Вместе с ней предоставляется шкала изменения цвета и соответствующие значения pH.
У индикаторной бумаги разных марок шаг чувствительности разный и варьирует от единиц до сотых.
В медицине определение кислотности имеет важное значение, так как многие процессы идут при определенной кислотности. Так, в ротовой полости среда щелочная и фермент слюны – амилаза – работает только в такой среде
В желудке среда кислая, что важно для пищеварительных ферментов желудка. При различных заболеваниях или вредных привычках может изменяться параметр кислотности, что служит важным диагностическим признаком.





























