Топ вопросов за вчера в категории Химия
Химия 20.06.2023 14:08 3908 Сапалов Андрей
№1. Определить валентность элементов в веществах. SiH4. CrO3. H2S. CO2. CO. SO3. SO2. Fe2O3. FeO.
Ответов: 1
Химия 19.07.2023 05:16 87 Malishava Tamriko
УМОЛЯЮ Растворимость сульфата натрия в 100 г воды при 20*С составляет 19,2 г, а при 30*С — 40.8 г. В
Ответов: 2
Химия 04.07.2023 11:21 291 Геленджик Маняня
Подсчитай, сколько теплоты выделяется при сгорании 5 моль углерода, если термохимическое уравнение
Ответов: 2
Химия 18.05.2023 16:56 1443 Амангелды Моля
Определить валентность: FeS, Al2S3, SCl2, SCl4, CO, CO2, Na3P, Ca3P2
Ответов: 2
Химия 30.06.2023 07:59 659 Шакуров Егор
Составьте формулы по валентности: ClO, AlS, PCl, PH, NaO, SO, ZnO, КS, CF,, NO, MgN, FeCl. 2. Опре
Ответов: 2
Химия 20.06.2023 08:33 326 Гарманова Даша
20 б! Практическая работа по химии(9 класс) 1. Докажите опытным путём состав: а) Серной кислоты; б
Ответов: 1
Химия 04.06.2023 01:57 227 Смирнова Наталья
Укажите, при взаимодействии каких веществ происходит реакция ионного обмена с выделением углекислого
Ответов: 1
Химия 03.10.2023 07:48 471 Коряшкин Максим
1. Найдите массу 1,5*1026 молекул оксида железа (II) FeO.
Ответов: 2
Химия 18.07.2023 12:21 651 Афанасьев Данил
Определить массу одной молекулы воды (H20, M=18г/моль) Помогите пожалуйста!!
Ответов: 3
Химия 04.07.2023 04:40 967 Кривич Алексей
Вопрос Верны ли следующие суждения об условиях протекания реакций ионного обмена? А. Если в раство
Ответов: 2
Последние заданные вопросы в категории Химия
Химия 22.10.2023 04:40 5 Арутюнова Влада
Здійснити перетворення: …………………. t°a) Si → SiO₂ → Na₂SiO3 → H₂SiO3 SiO₂; b) P→ P₂O5
Ответов: 1
Химия 22.10.2023 04:40 28 Демидчик Алеся
Яку масу води та цукру треба взяти, щоб приготувати 200 г розчину масовою часткою цукру 10%?
Ответов: 1
Химия 22.10.2023 04:39 10 Попова Арина
СРОЧНОООО️️️️ Установіть генетичний ланцюжок добування оксиду метала: а) ферум(2) хлорид б) за
Ответов: 1
Химия 22.10.2023 04:37 13 Мухангалиева Анеля
Вказати основний оксид: a. SnO2 b. V2O5 c. CdO d. Sb2O3
Ответов: 2
Химия 22.10.2023 04:37 19 Назин Егор
Скільки атомів кожного елемента у цих формулах з урахуванням коефіцієнтів: 302, 20, 2H2O, H2SO4, C
Ответов: 1
Химия 22.10.2023 04:37 9 Самарьянц Андрей
Назовите вещества пжпжппжпжпжп
Ответов: 1
Химия 22.10.2023 04:37 18 Лонгольф Костя
В какой среде находится изоэлектрическая точка трипептидов: а) аланил-треонил-фенилаланин б) валил
Ответов: 2
Химия 22.10.2023 04:36 9 Подольная Настя
Скласти структурні формули таких вуглеводніві визначити їх назву за номенклатурою IЮПAК: (СН3)3ССН(С
Ответов: 1
Химия 22.10.2023 04:35 19 Кот Никита
Для поглинання сульфур 4 оксиду з димових газів застосовують розчин амоній сульфіту (NH4)2SO3. Відбу
Ответов: 2
Химия 22.10.2023 04:35 15 Лис Максим
Відповідність між формулами оксидів та кислот
Ответов: 1
Значение гидратированного иона
Гидратация — это процесс, при котором ион взаимодействует с молекулами воды и образует комплекс гидратированного иона. Гидратированный ион состоит из иона и водородных связей с водными молекулами. Гидратация имеет большое значение для химических реакций в растворах, так как влияет на растворимость веществ и их реакционную способность.
Гидраты ионов обладают отличными физическими и химическими свойствами по сравнению с негидратированными ионами. Гидратированные ионы обычно имеют больший размер и массу, что может влиять на их движение и реакционную активность в растворе. Кроме того, гидратированные ионы могут образовывать специфические структуры и комплексы с другими веществами, что может влиять на их реакционную способность и стабильность.
Гидратация также влияет на растворимость веществ в воде. Многие соли и неорганические соединения могут образовывать гидраты с различным количеством молекул воды. Например, сульфат меди пентагидрат имеет формулу CuSO4·5H2O, что означает, что каждый ион меди(II) связан с пятью молекулами воды. Растворимость соли может изменяться в зависимости от температуры и давления, а также наличия или отсутствия других реагентов.
Гидратация может также влиять на скорость химических реакций. Некоторые реакции могут происходить только с гидратированными ионами, в то время как другие реакции могут быть ускорены или замедлены из-за наличия или отсутствия гидратации. Кроме того, гидратированные ионы могут образовывать реакционные центры источники протонов или электронов, что может быть важным при проведении электролиза или других электрохимических процессов.
Гидратированные ионы: понятие, процесс образования и свойства
Гидратированные ионы – это ионы, которые окружены молекулами воды и образуют игриды, или комплексы, с водными молекулами. Гидратация иона происходит в результате притяжения иона к положительным полюсам водных молекул, так как вода является полярным растворителем.
Ключевым представителем гидратированных ионов является H3O+. Это ион гидрония, образованный в результате протонации воды. В процессе протонации одна из молекул воды переходит в положение катиона, при этом образуется анион OH-. Вместе они образуют гидроксония – основную составляющую кислотных растворов.
Гидратированные ионы обладают рядом свойств:
- Гидратированные ионы обладают большей массой, чем незамедлительные ионы, так как молекулы воды, окружающие ион, добавляют дополнительную массу.
- Гидратированные ионы имеют больший размер, так как водные молекулы, окружающие ион, увеличивают его объем.
- Гидратированные ионы обладают измененной химической активностью и реакционной способностью по сравнению с незамедлительными ионами.
- Гидратированные ионы способны образовывать сеть гидратации, при которой каждый ион окружен своими собственными молекулами воды.
- Гидратированные ионы могут подвергаться диссоциации, при которой молекулы воды легко отделяются от иона.
Данные свойства гидратированных ионов играют важную роль во многих процессах, происходящих в водных растворах, и дополняют наше понимание об ионной химии и воде в целом.
Что такое гидратация и почему она важна для образования гидратированных ионов?
Гидратация — это процесс образования гидратированных ионов путем присоединения водных молекул к заряженным ионам. Когда ион встречается с молекулой воды, она становится гидратированным, то есть окруженным слоем водных молекул.
Это явление играет важную роль в химических реакциях и взаимодействиях водных растворов. Гидратированные ионы обладают особыми свойствами и могут влиять на химическую активность раствора. Они могут образовывать осадки, участвовать в реакциях окисления-восстановления, а также способствовать проводимости электрического тока в растворе.
Одним из наиболее известных примеров гидратации является образование ионов гидроксония H3O+. Ион гидроксония образуется в результате протонирования воды, то есть передачи протона одной молекуле воды другой. H3O+ является главной кислотной формой протонированной воды и играет важную роль в кислотно-щелочных реакциях и в поддержании кислотно-щелочного баланса в растворах.
| Примеры гидратированных ионов | Формула | Заряд |
|---|---|---|
| Катион гидроксония | H3O+ | 1+ |
| Катион гидросульфона | HSO4- | 1- |
| Катион гидроксида | OH- | 1- |
Гидратация является важным процессом в химической и биологической люминесценции, электрохимических реакциях и других химических процессах. Она помогает понять и объяснить различные явления, происходящие в жидкостях и растворах, и играет важную роль в науке и промышленности.
Таким образом, гидратация играет важную роль в образовании гидратированных ионов и является ключевым фактором, определяющим свойства и поведение растворов.
Как происходит образование гидратированных ионов в растворе?
В растворе ионы обычно окружены молекулами растворителя, которые называются гидратирующими молекулами. Гидратированные ионы образуются в результате взаимодействия ионов с молекулами растворителя.
Скажите, при растворении в воде, ионы создают вокруг себя оболочку из водных молекул. Это происходит из-за взаимодействия положительно или отрицательно заряженных ионов с дипольными молекулами воды.
Значит, образование гидратированных ионов в растворе воды происходит путем образования комплекса, включающего ион и молекулы воды. Гидратированные ионы можно обозначить в виде формулы, в которой присутствуют ион и молекулы воды, например, Na+(aq) или Cl—(aq).
h3o — это электронная формула для гидратированного иона водорода (H3O+). Он образуется в результате протолиза воды, когда вода принимает протон от другой молекулы воды, образуя H3O+.
Таким образом, образование гидратированных ионов в растворе является важной концепцией в химии и играет важную роль в химических реакциях и свойствах растворов. В таблице ниже приведены примеры гидратированных ионов:
В таблице ниже приведены примеры гидратированных ионов:
| Ион | Гидратированный ион |
|---|---|
| Li+ | Li+(aq) |
| Na+ | Na+(aq) |
| Mg2+ | Mg2+(aq) |
| Cl— | Cl—(aq) |
Гидратированные ионы: основные факты и свойства
Гидратированные ионы представляют собой ионы, которые окружены оболочкой водных молекул. Они образуются в результате растворения солей или других химических соединений в воде.
Гидратированные ионы имеют важное значение в химии и химическом анализе. Они обладают различными свойствами, такими как электролитность, растворимость и устойчивость в водных растворах
Электролитность гидратированных ионов обусловлена их способностью разделяться на положительно и отрицательно заряженные части, которые являются основой для проведения электрического тока в растворе.
Растворимость гидратированных ионов зависит от природы ионов и их заряда. Некоторые ионы имеют высокую растворимость, тогда как другие могут быть практически нерастворимыми. Это свойство используется для разделения ионов в процессе химических аналитических методов.
Устойчивость гидратированных ионов в водных растворах определяется силой связи между ионом и оболочкой водных молекул. Более сильные связи приводят к более стабильным гидратам, которые могут существовать в растворе в течение длительного времени.
Важно отметить, что гидратированные ионы не всегда сохраняют свои структуры и свойства при изменении условий, таких как температура и давление. При определенных условиях гидраты могут дезгидратироваться и образовывать новые соединения
Клатратные соединения
Благородные газы (аргон и др.), простые углеводороды и многие другие вещества образуют с водой так называемые кристаллические гидраты; так, ксенон образует гидрат Хе . 53/4 Н2О, устойчивый примерно при 2°С и парциальном давлении ксенона 1 атм; метан образует аналогичный гидрат CH4 . 53/4 Н2О.
Рентгеноскопические исследования показали, что эти кристаллы имеют структуру, в которой молекулы воды образуют благодаря водородным связям решетку, напоминающую решетку льда; в ней каждая молекула воды окружена четырьмя другими молекулами, расположенными в вершинах тетраэдра на расстоянии 276 пм, но с более открытым расположением молекул, что обусловливает образование полостей (в форме пентагональных додекаэдров или других многогранников с пентагональными или гексагональными гранями), достаточно больших, чтобы в них могли помещаться атомы газов или другие молекулы (рисунок 2). Кри сталлы такого типа называют клатратными кристаллами.
Структура гидрата ксенона и гидратов аргона, криптона, метана, хлора, брома, сероводорода и некоторых других веществ показана на рис. 2. Кубическая ячейка данной структуры имеет ребро около 1200 пм и содержит 46 молекул воды.
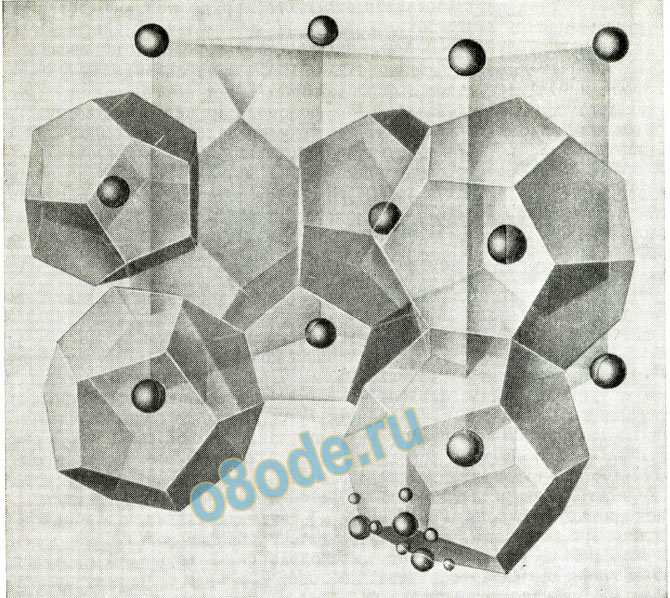
Рисунок 2. Структура клатратного кристалла гидрата ксенона.
Атомы ксенона занимают пустоты (восемь на кубическую ячейку) в трехмерной решетке, образо ванной молекулами воды с участием водородных связей (46 молекул на кубическую ячейку). Рас стояние О—Н • • • О равно 276 пм, как в кристалле льда. Два атома ксенона при атомах кислорода О О О и ½ ½ ½ находятся в центрах почти правильных пентагональных додекаэдров. Остальные шесть атомов ксенона при О ¼ ½; O ¾ ½; ½ O ¼; 1/2O ¾; ¼ ½ O находятся в центрах четырнадцатигранников. Каж дый четырнадцатигранник (один из них выделен в центре рисунка) имеет 24 вершины (молекулы воды), две шестиугольные грани и 12 пятиугольных граней.
Гидрат хлороформа СНС13 .17Н2О имеет несколько более сложную структуру, в которой молекула хлороформа окружена 16-сторонним многогранником, образованным 28 мо лекулами воды. Можно получить также клатратные соединения, в которых кри сталлическая решетка с водородными связями образована органически ми молекулами, например молекулами мочевины (H2N)2CO.
Была предложена интересная интерпретация механизма действия химически инертных анестезирующих средств, например галотана F3CCBrClH и ксенона. Согласно этому механизму, анестезирующее вещество нарушает водную структуру межклеточной или внутриклеточ ной жидкости путем образования клатратных структур, воздействую щих на нормальные межклеточные системы связи. Местные анестези рующие средства отличаются по механизму своего действия. Их молекулы могут образовать водородные связи, и, вероятно, анестезирующее действие является результатом соединения молекул анестезиру ющего вещества с белковыми молекулами или другими молекулами, входящими в состав нервов.
Другие растворители электролитов
Помимо воды и некоторые другие жидкости могут служить ионизирующими растворителями электролитов с образованием растворов, проводящих электрический ток. К таким жидкостям относятся перекись водорода, фтористый водород, жидкий аммиак и цианистый водород. Подобно воде, все эти жидкости имеют большую диэлектрическую прони цаемость. Жидкости с малой диэлектрической проницаемостью, такие, как бензол или сероуглерод, не являются ионизирующими растворите лями.
Жидкости с большой диэлектрической проницаемостью иногда называют полярными жидкостями.
Высокая диэлектрическая проницаемость воды, обуславливающая поразительную способность воды растворять вещества ионного строе ния, отчасти является следствием того, что вода способна образовывать водородные связи. Благодаря этим связям молекулы воды располагаются так, чтобы частично нейтрализовать электрическое поле. Водород ные связи образуются также и в других жидкостях — в перекиси водо рода, фтористом водороде, аммиаке (температура кипения — 33,4 °С), цианистом водороде], которые способны растворять вещества, облада ющие ионным строением.
Шпаргалки по электрохимии. Часть 2 — Теплоты сольватации (гидратации)
| Cмотрите так же… |
|---|
| Шпаргалки по электрохимии. Часть 2 |
| Теплоты сольватации (гидратации) |
| Энтропия сольватации. Число сольватации |
| Активность и коэффициент активности электролита |
| Теория электролитов Дебая и Гюккеля |
| Теория электролитов Дебая и Гюккеля |
| Электропроводность растворов электролитов |
| Подвижность ионов. Закон Кольрауша |
| Подвижность ионов гидроксония и гидроксила |
| Зависимость подвижности ионов от концентрации |
| Числа переноса ионов. Методы определения чисел переноса |
| Ионное равновесие в растворах электролитов |
| Буферные растворы |
| Гальванические элементы |
| Электродный потенциал. Водородная шкала потенциалов |
| Стандартный электродный потенциал |
| All Pages |
Page 2 of 16
Теплотысольватации (гидратации)
Процесс электролитической диссоциации требует значительной затраты энергии. Происхождение этой энергии даже не рассматривалось в теории Аррениуса. По общепринятым сейчас представлениям, энергия, обеспечивающая появление ионов, выделяется в самом процессе электролитической диссоциации и представляет собой результат взаимодействия растворяемого вещества и растворителя. Благодаря этому взаимодействию образуются комплексы, содержащие молекулы растворителя – сольватированные (гидратированные) ионы. Энергетические эффекты, наблюдающиеся при этом, были названы, по предложению Фаянса (1915), энергиями сольватации (DGs) или, в водных средах, гидратации (DGг), а соответствующие тепловые эффекты – теплотами сольватации (– DНs = ) и гидратации (– DНг = ).
Все вещества, образующие ионы при растворении, можно разбить на две группы в зависимости от их строения и природы связей. К первой из них относятся соединения, кристаллическая решетка которых построена из ионов, – ионофоры. Для таких веществ термин «электролитическая диссоциация» не очень удачен, так как в них и до процесса растворения не было молекул. Сольватация в этом случае является источником энергии не процесса диссоциации молекул, а процесса разрушения решетки с образованием свободных ионов. Поэтому в растворителях с высокой диэлектрической проницаемостью все ионофоры – сильные электролиты. К другой группе относятся молекулярные вещества – ионогены. Образование ионов при растворении ионогенов происходит лишь благодаря их химическому взаимодействию с растворителем. Энергия, необходимая для разрыва химической связи, компенсируется энергией связи протона с молекулой воды в ионе гидроксония (если один из ионов – ион водорода) и энергией гидратации ионов Н3О+ и А–. Ионогены в водных растворах – обычно слабые электролиты.
И для ионофоров, и для ионогенов конечными продуктами взаимодействия между растворяемым веществом и растворителем являются сольватированные ионы, а энергетические эффекты проявляются как энергии сольватации. Чтобы доказать это, надо рассчитать энергию сольватации и сопоставить ее с энергией кристаллической решетки (энергией химической связи). Если эти энергии окажутся близкими, то вывод о разрушении решетки соли (нейтральной молекулы ионогена) за счет ион-дипольного взаимодействия можно считать правильным.
Энергии и теплоты сольватации электролитов впервые были рассчитаны Борном и Габером (1919) при помощи циклов, основанных на законе Гесса.
NaCl (кр)Na+(газ)+Cl–(газ)
DHLDHs+DHs–
Na+ (aq)+Cl– (aq)
DHNaCl – изменение энтальпии в ходе разрушения кристаллической решетки хлорида натрия (связь с энергией решетки: DGp = DHNaCl – TDS; при 298КTDS составляет приблизительно 15 кДж/моль);
DHL – теплота растворения хлорида натрия, экстраполированная на бесконечно разбавленный раствор соли;
DHs+ , DHs– – теплоты сольватации катиона и аниона.
Из этого цикла для теплоты сольватации хлорида натрия получаем:
DHsNaCl=DHs++DHs–=DHL–DHNaCl=4–772=– 768 кДж/моль.
Данное уравнение позволяет найти теплоту гидратации, если известны теплота растворения и энергия решетки. Теплоту растворения находят экспериментально, а энергии решеток рассчитывают либо по соответствующим уравнениям, либо из циклов, используя другие экспериментально определимые величины.
Методы определения гидратированных ионов
Гидратированные ионы – это ионы, которые содержат связанные с ними водные молекулы. Они образуются в результате растворения солей или других веществ в воде.
Существует несколько методов, которые позволяют определить наличие и количество гидратированных ионов:
- Гравиметрический метод – основан на измерении массы образовавшегося осадка, который образуется при удалении воды из раствора. Осадок содержит гидратированные ионы, и его масса позволяет оценить количество этих ионов в растворе.
- Титриметрический метод – основан на использовании реактивов, которые проявляют специфическую реакцию с гидратированными ионами. Путем титрования можно определить концентрацию гидратированных ионов в растворе.
- Спектроскопический метод – основан на измерении спектров поглощения или испускания света гидратированными ионами. Этот метод позволяет определить как наличие гидратированных ионов, так и их концентрацию.
- Электрохимический метод – основан на измерении электрических свойств растворов с гидратированными ионами. Этот метод позволяет определить как ионизацию гидратированных ионов, так и их концентрацию.
- Рентгеноструктурный метод – основан на анализе рентгеновской дифракции кристаллов с гидратированными ионами. По характеристикам дифракционных пиков можно определить количество ионов в кристаллической решетке.
Каждый из этих методов имеет свои преимущества и ограничения, и выбор метода зависит от целей и условий исследования. Комбинированное исследование с использованием нескольких методов может дать более полную информацию о гидратированных ионах в растворах.
Теория электролитической диссоциации
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов.
Электролитической диссоциацией называется распад электролитов на ионы при растворении их в воде.
Теория электролитической диссоциации (С. Аррениус, 1887) в современном понимании включает следующие положения:
электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные (катионы) и отрицательные (анионы). Ионизация происходит легче всего для соединений с ионной связью (солей, щелочей), которые при растворении (эндотермический процесс разрушения кристаллической решетки) образуют гидратированные ионы.
Рис. 3. Схема электролитической диссоциации соли.
Гидратация ионов – экзотермический процесс. Соотношение затраты и выигрыша энергии определяет возможность ионизации в растворе. При растворении вещества с полярной ковалентной связью (например, хлороводород HCl) диполи воды ориентируются у соответствующих полюсов растворяемой молекулы, поляризую связь и превращая ее в ионную с последующей гидратацией ионов. Этот процесс является обратимым и может идти как полностью, так и частично.
- гидратированные ионы устойчивы, беспорядочно передвигаются в растворе. Под действием электрического тока движение приобретает направленный характер: катионы движутся к отрицательному поясу (катоду), а анионы – к положительному (аноду).
- диссоциация (ионизация) – обратимый процесс. Полнота ионизации зависит от природы электролита (соли щелочи диссоциируют практически нацело), его концентрации (с увеличением концентрации ионизация идет труднее), температуры (повышение температуры способствует диссоциации), природы растворителя (ионизация происходит только в полярном растворителе, в частности, в воде).
Что мы узнали?
Электролиты – это соли, кислоты, основания, способные проводить электрический ток. Электролиты бывают сильные и слабые. Также в статье приводится информация кратко о соединениях электролитов.
-
/10
Вопрос 1 из 10
Что подходит под определение электролита?
- они проводят электрический ток
- они не проводят электрический ток
- к электролитам относятся вещества с металлической связью
- нет ни одного правильного ответа
Понятие гидратированных и негидратированных ионов
В химии принято делить ионы на гидратированные и негидратированные в зависимости от их способности привлекать молекулы воды и образовывать с ними гидратированные комплексы.
Гидратированные ионы образуются, когда ион привлекает молекулы воды и окружает их своими заряженными частичками. Это происходит благодаря образованию водородных связей между ионом и молекулами воды. Гидратированные ионы обычно обозначаются в скобках с указанием количества молекул воды, например, CuSO4·5H2O.
Негидратированные ионы, наоборот, не образуют гидратированных комплексов с молекулами воды. Они обычно представлены в виде обычных химических формул без указания воды, например, NaCl.
Ионная гидратация имеет большое значение в химических реакциях и различных химических процессах. Гидратированные ионы могут взаимодействовать с другими веществами, образуя новые соединения или меняя свои свойства. Также гидратированные ионы могут образовывать кристаллы или осаждаться из раствора в виде отдельных частиц.
Важно отметить, что гидратированные ионы могут легко терять свою гидратированность при нагревании или при длительном хранении в сухих условиях. Поэтому при описании вещества часто указывают условия, при которых гидратированный ион переходит в негидратированное состояние
В заключение, деление ионов на гидратированные и негидратированные помогает учитывать их способность взаимодействовать с водой и понимать их свойства и реакционную способность в различных химических системах.
Определение гидратации
Гидратация — процесс, при котором молекулы воды образуют оболочку вокруг ионов или молекул, обеспечивая их стабильность и устойчивость в растворе. В результате гидратации, ионы становятся гидратированными или обволакиваются в молекулы воды.
Принято делить ионы на гидратированные и негидратированные в зависимости от наличия или отсутствия водных оболочек. Гидратированные ионы имеют одну или несколько молекул воды, связанных с ними и образующих гидратированную сферу. Негидратированные ионы не имеют водных оболочек и не связаны с молекулами воды.
Почему принято делить ионы на гидратированные и негидратированные? Это связано с важностью понимания роли водных оболочек в химических реакциях и взаимодействиях ионов с другими веществами. Гидратированные ионы обладают определенными свойствами, такими как растворимость, электропроводность и возможность участвовать в реакциях
При этом, гидратация может влиять на свойства ионы и их химическое поведение. Например, гидратированные ионы могут быть более или менее активными при взаимодействии с другими веществами.
Характеристики гидратированных и негидратированных ионов
Гидратированные ионы — это ионы, которые связаны с молекулами воды. Процесс связывания ионов с молекулами воды называется гидратацией. Ионы могут образовывать гидратированные соединения, известные как гидраты, в которых ионные частицы окружены молекулами воды.
Почему принято делить ионы на гидратированные и негидратированные?
Гидратированные ионы обладают некоторыми особенностями, которые делают их важными в химии:
- Гидратированные ионы могут образовывать комплексы с другими молекулами или ионами. Это позволяет им участвовать в реакциях, влиять на растворимость вещества и взаимодействовать с другими химическими веществами.
- Гидратированные ионы имеют различные свойства, такие как заряд, размер и форму. Эти свойства могут влиять на процессы, в которых участвуют ионы, и на их взаимодействие с другими веществами.
- Гидратированные ионы могут быть легко определены и анализированы с помощью различных методов, таких как спектроскопия, электрохимические методы и хроматография.
С другой стороны, негидратированные ионы не связаны с молекулами воды. Они обычно имеют свои собственные характеристики и взаимодействуют с другими веществами в соответствии с ними.
Разделение ионов на гидратированные и негидратированные позволяет более точно описывать их свойства и взаимодействия в химических реакциях
Это важно для понимания и применения ионов в различных областях химии и науки в целом
Как образуются гидратированные ионы?
Гидратированные ионы образуются в процессе растворения в воде. Когда ион взаимодействует с водными молекулами, происходит образование водной оболочки вокруг иона, состоящей из молекул воды, называемой гидратной оболочкой. Вода притягивается к заряженным частицам посредством электростатического взаимодействия.
Процесс гидратации ионов может быть физическим или химическим в зависимости от степени привязанности водных молекул к иону. Физическая гидратация происходит, когда водные молекулы просто адсорбируются на поверхности иона. Химическая гидратация, с другой стороны, является более стабильной и долговременной, поскольку водные молекулы образуют химическую связь с ионом.
Гидратированные ионы могут образовываться как с положительно, так и с отрицательно заряженными ионами. Вода может гидратировать катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы), образуя гидратные ионы. Гидратированные ионы являются основными компонентами раствора и важными для понимания многих химических процессов и реакций.
| Примеры гидратированных ионов: | Формула |
|---|---|
| Гидратированный натриевый ион | Na+(aq) |
| Гидратированный хлоридный ион | Cl—(aq) |
| Гидратированный магниевый ион | Mg2+(aq) |
| Гидратированный гидроксидный ион | OH—(aq) |
Диссоциация электролитов
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. Первые в виде ионов существуют еще до перевода их в растворенное или расплавленное состояние. К электролитам относятся соли, основания, кислоты.
Рис. 1. Таблица отличие электролитов от неэлектролитов.
Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся: почти все растворимые соли, многие неорганические кислоты (например, H2SO4, HNO3, HCl), гидроксиды щелочных и щелочноземельных металлов. Слабые электролиты при растворении в воде незначительно диссоциируют на ионы. К ним относятся почти все органические кислоты, некоторые неорганические кислоты (например, H2CO3), многие гидроксиды (кроме гидроксидов щелочных и щелочноземельных металлов).
Рис. 2. Таблица сильные и слабые электролиты.
Вода также является слабым электролитом.
Как и другие химические реакции, электролитическую диссоциацию в растворах записывают в виде уравнений диссоциации. При этом для сильных электролитов рассматривают процесс как идущий необратимо, а для электролитов средней силы и слабых – как обратимый процесс.
Кислоты – это электролиты, диссоциация которых в водных растворах протекает с образованием ионов водорода в качестве катионов. Многоосновные кислоты диссоциируют ступенчато. Каждая следующая ступень идет все с большим и большим трудом, так как образующиеся ионы кислотных остатков являются более слабыми электролитами.
Основания – электролиты, диссоциирующие в водном растворе с образованием гидроксид-иона ОН- в качестве аниона. Образование гидроксид-иона является общим признаком оснований и обуславливает общие свойства сильных оснований: щелочной характер, горький вкус, мылкость на ощупь, реакцию на индикатор, нейтрализацию кислот и т. д.
Щелочи, даже малорастворимые (например, гидроксид бария Ba(OH)2) диссоциируют нацело, пример:
Ba(OH)2=Ba2+2OH-
Соли – это электролиты, диссоциирующие в водном растворе с образованием катиона металла и кислотного остатка. Соли диссоциируют не ступенчато, а нацело:
Сa(NO3)2=Ca2+ +2NO3–




























