Общие способы получения алкинов
В природе ацетиленовые углеводороды не встречаются; их
получают путем синтеза.
Отщепление галогеноводорода от дигалогенпроизводных
При действии спиртового раствора щелочи на
дигалогенпроизводные углеводородов происходит отнятие двух молекул
галогенводорода. При этом в исходном дигалогенпроизводном атомы галогена могут
быть расположены при одном и том же углеродном атоме, либо при двух различных,
но обязательно соседних атомах:
Н—СН—Н
2КОН СН
I
¾¾ III + 2КBr + 2H2O
Br—CH—Br спирт
СН
1,1-дибромэтан
Н Cl
½ ½ 2KOH
CH3—C—CH ¾¾ CH3—CºCH +2KCl + 2H2O
½ ½ спирт пропин
1,2-дихлорпропан Сl H
Исходные в этих реакциях дигалогенпроизводные с атомами
галогена при соседних атомах углерода могут быть получены присоединением
галогенов к этиленовым углеводородам. Следовательно, углеводороды с двойной
связью через дигалогенпроизводные могут быть превращены в ацетиленовые
углеводороды (с тройной связью).
Действие галогенпроизводных на ацетилениды
Удобный способ получения гомологов ацетилена –
действие галогенпроизводных (галогеналкилов и галогенарилов) на ацетилениды.
Например:
CHºC—Ag +
I—CH2—CH3 ¾ CHºC—CH2—CH3 +
AgI
моносеребряный иодистый
ацетиленид этил
СH3—I + Na—CºC—Na + I—CH3 ¾ CH3—CºC—CH3 + 2NaI
иодистый
динатриевый иодистый
метил ацетиленид метил
—I
+ CH3—CºC—Cu ¾ —CºC—CH3 + CuI
Этот метод дает возможность переходить от простых
ацетиленовых углеводородов к более сложным.
Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
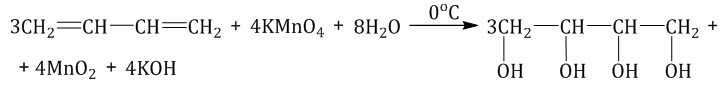
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
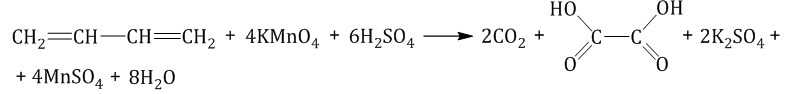
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
| Например, уравнение сгорания бутадиена: |
2C4H6 + 11O2 → 8CO2 + 6H2O
Изомерия и номенклатура
Если рассматривать изометрию алкадиенов, то здесь следует сказать, что для них характерна, как структурная изометрия, так и пространственная.
На рисунке внизу мы видим примеры структурной и пространственной изометрии:
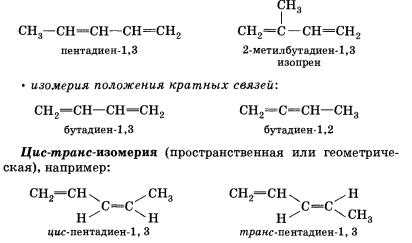
Что же касательно составления названий алкадиенов, то здесь существуют следующие правила:
• Во-первых, основная цепь в обязательном порядке должна содержать две двойные связи;
• Во-вторых, нумерацию, как правило начинают с того конца, с которого ближе расположена кратная связь;
• В-третьих, дают названия заменителям и указывают атомы углерода, от которого они отходят;
• В-четвертых, атомы углерода дают название алкадиена, как правило, от тех атомов, от которых была образована двойная связь.
Натуральный и синтетический каучуки. Резина
Пока человек не научился производить синтетический каучук, до тех пор в промышленности использовали натуральный каучук. Получали такой каучук с помощью каучуконосных растений, методом выделения млечного сока, то есть так называемого латекса. Наиболее ценным растением по выделению природного каучука считалась произрастающая в Латинской Америке гевея.
В этой области было проведено огромное количество исследований, которые выявили, что
натуральный каучук имеет в своем составе цис-полиизопрен, то есть, это такой полимер, который по своему строению соответствует изопрену (2-метилбутадиену-1,3).
Но благодаря проведению различных опытов и исследований, американский изобретатель Чарльз Нельсон Гудьир сумел провести вулканизацию каучука. Им было обнаружено, что
что при нагревании каучука с серой в итоге получается довольно таки эластичный материал, который даже по техническим характеристикам превосходит каучук. Вот таким методом Гудьиру удалось получить резину.
Чарльз Нельсон проведя вулканизацию, заметил, что за счет сульфидных мостиков происходит сшивание полимерных цепей и в итоге увеличивается прочность и устойчивость к различным органическим веществам и растворителям.
А так как в двадцатом веке начался стремительный рост промышленности, то и потребность в каучуке также возросла. Но использование в промышленных масштабах природного каучука было не рентабельно и довольно таки дорого, то ученым пришлось искать пути получения синтетического каучука.
Но, первоначально не все так просто складывалось в этой области, и первый полученный каучук отдаленно напоминал смолу, которая к тому же, при ее вулканизации имела очень плохое качество.
Как вам уже известно, из сегодняшнего урока, синтетический каучук был получен по методу химика С.В.Лебедева только в 1932 году, тогда же его производство и приобрело промышленные масштабы.
В основе такого технологически удобного способа получения каучука, лежала полимеризация бутадиена-1,3 с использованием такого катализатора, как металлический натрий.
Благодаря этой технологии удалось получить полибутадиен, который обладал довольно неплохими технологическими свойствами. Но и здесь не все было так гладко, как хотелось, потому что, полученный полимер был нестерео-регулярным и соответственно, произведенная на его основе резина не отличалась особой эластичностью и уступала качеству резины, полученной из природного каучука.
А вот изопреновые и стерео-регулярные полимеры ученым удалось получить только в пятидесятых годах двадцатого века.
Конечно же, в настоящее время, современные технологии в химической промышленности позволяют производить не один, а несколько видов синтетического каучука. Широкое использование в качестве мономеров получили такие типы синтетических каучуков, как изопреновый, бутадиеновый, хлоропреновый, стирольный и т.д.
Также, большой популярностью пользуется резина, которая произведена на основе сополимеров алкадиенов, сочлененными двойными связями, а также производные алкенов.
Для таких видов резины характерны: хорошая эластичность, прочность и морозоустойчивость. Кроме того, эти виды резины обладают пониженной газопроницаемостью, а также устойчивы к действию ультрафиолета и различных окислителей.
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
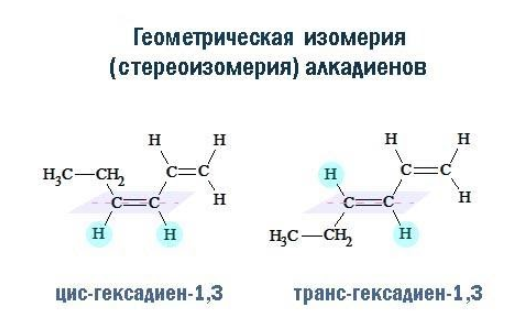
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен |
транс-Алкадиен |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
|
Например.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода) |

Номенклатура алкадиенов
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
| Например, алкадиен имеет название бутадиен-1,3. |
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
| Тривиальное название | Формула алкадиена |
| Дивинил | |
| Изопрен |
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
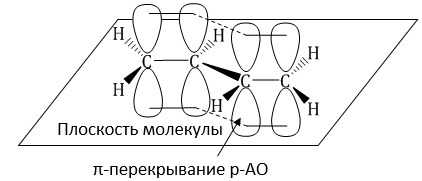
Это соответствует плоскому строению молекулы бутадиена-1,3.
| Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей. |
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например, 2-метилбутадиен-1,3:
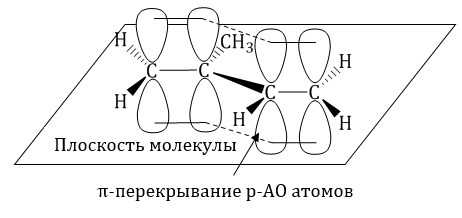
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Виды алкадиенов, классификация, изомерия
При формулировке наименования алкадиенов, чтобы обозначить две двойные связи, используют суффикс «-диен». К примеру, алкадиен с четырьмя атомами углерода обладает названием бутадиен-1,3.
Правила формирования названий алкадиенов похожи на формулировку названий алкенов. Простейшие алкадиены традиционно обладают тривиальными наименованиями.
Классификация диенов основана на взаимном расположении кратных связей. Выделяют следующие основные группы веществ:
- диены, которые обладают алленовыми, или кумулированными связями (1,2-диены);
- диены, для которых характерны сопряженные связи, с разделенными двойными связями с помощью одной одинарной (1,3-диены);
- диены, которые имеют изолированные связи, при этом двойные связи разделены больше, чем одной одинарной.
Гетероаналоги диенов, для которых характерно замещение одного из ненасыщенных углеродных атомов углерода с помощью гетероатома, носят название гетеродиенов.
Виды изомерии, характерные для алкадиенов:
- структурная;
- пространственная.
Виды структурной изомерии, характерной для алкадиенов: изомерия углеродного скелета, изомерия расположения кратных связей и межклассовая изомерия. Структурными изомерами называют соединения, идентичные по составу, но отличающиеся в зависимости от порядка связывания атомов в молекуле, то есть имеющие разное строение молекул.
Изомеры положения двойных связей характеризуются различным расположением двойных связей. В качестве примера можно привести изомеры положения двойных связей гексадиена — гексадиен-1,3 и гексадиен-2,4.
Межклассовыми изомерами называют вещества из разных классов, которые отличаются по строению, но обладают идентичным составом. Алкадиены представляют собой межклассовые изомеры алкинов и циклоалкенов с общей формулой:
В качестве примера межклассовой изомерии можно привести межклассовые изомеры с общей формулой : бутадиен-1,3, бутин-1, циклобутен.
Изомеры углеродного скелета имеют разное строение углеродного скелета. В качестве примера можно привести изомеры углеродного скелета : пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен).
Определенные алкадиены характеризуются пространственной изомерией:
- цис-транс-изомерия;
- оптическая изомерия.
Алкадиены с достаточно длинным углеводородным скелетом могут обладать оптической изомерией. При этом обязательным условием является присутствие в молекуле асимметрического углеродного атома, который связан с четырьмя разными заместителями.
Причиной существования цис-транс-изомерии является невозможность вращения фрагментов молекул относительно двойных связей. Вещества, обладающие различными заместителями у каждого из пары углеродных атомов при двойных связях, могут существовать в виде двух изомеров. Они отличаются положением заместителей по отношению к плоскости –связи.
Алкадиены с одинаковыми заместителями, расположенными с одной стороны относительно плоскости двойной связи, являются цис-изомерами. Вещества с одинаковыми заместителями, которые расположены с разных сторон плоскости двойной связи, носят название транс-изомеров.
Цис-транс-изомерия не наблюдается у таких алкадиенов, в которых хотя бы один из углеродных атомов при двойной связи соединен с двумя идентичными заместителями. В качестве примера можно привести бутадиен-1,3. Для данного алкадиена не характерна цис-транс-изомерия по причине наличия у одного из углеродных атомов при двойной связи пары идентичных заместителей (два атома водорода).
Отдельные представители
Ацетилен. Представляет собой бесцветный горючий и
взрывоопасный газ; Ткип. –83,6 оС. Теплота сгорания 48116 Кдж/моль; 1 объем
С2Н2 растворяется в 1 объеме воды при 20 оС. Температура самовоспламенения 335
оС; нижний предел воспламенения 2,5 % объемных, верхний предел воспламенения в
воздухе зависит от энергии источника зажигания. Ацетилен разлагается с большим выделением
тепла и, при определенных условиях, со взрывом. Для предупреждения взрыва при
аварийном истечении ацетилена и тушения факела в закрытых объемах минимальная
концентрация СО2 57 % объемных, азота – 70 % объемных.
В чистом виде почти не имеет запаха; неприятный запах
технического ацетилена обусловлен наличием в нем примесей. На воздухе ацетиле
горит сильно коптящим пламенем.
В технике громадное количество ацетилена получают действием
воды на карбид (ацетиленид) кальция СаС2 по реакции (Велер, 1862г.):
С CН
III Ca +
2HOH ¾ III +
Ca(OH)2
C CН
карбид
кальция
В свою очередь карбид кальция получают в электрических
печах из негашеной извести и угля:
СаО + 3 С ¾ СаС2 + СО
Очень важным современным методом получения ацетилена
является термоокислительный крекинг метана, входящего в состав природных газов
(при температуре свыше 1500 оС). Теплота выделяется при сгорании метана в
присутствии недостаточного количества кислорода:
1500
оС
6СН4 + 4О2 ¾¾ СНºСН + 8Н2 + 3СО + СО2 + Н2О
Ацетилен является ценным исходным веществом для многих
промышленных синтезов. Из него по реакции Кучерова получают уксусный альдегид,
который затем переводят либо в уксусную кислоту, либо в этиловый спирт.
Ацетилен служит исходным материалом для получения особого вида синтетического
каучука (полихлоропренового), пластмасс, из него получают различные
растворители; он может быть исходным веществом для синтеза ароматических
углеводородов и т.п. Все эти крайне разнообразные и ценные продукты, главным
образом, получаются через ацетилен из весьма доступного сырья – извести и угля
или из метана природного газа.
Ацетилен широко применяли для освещения; с этой целью
использовали специальные горелки, в которых происходило хорошее смешение
ацетилена с воздухом и получалось яркое пламя. Если в пламя горящего ацетилена
вдувать кислород, то достигается высокая температура, при которой плавятся
металлы. На этом основано применение ацетилена для автогенной сварки.
Ацетилен очень опасен в обращении. С воздухом или с
кислородом образует гремучую смесь (1 объем ацетилена и 2,5 объема кислорода);
сильно взрывчаты ацетилениды серебра и меди. Для работы ацетилен, получив его
тем или иным способом, либо сазу же пускают в реакцию, либо предварительно
набирают в стальные баллоны, в которых его растворяют в ацетоне под давлением
12-15 атмосфер.
Химические свойства
Как вам уже известно, химические и физические свойства алкадиенов имеют много общего с алкенами, хотя алкадиены с сопряженными связями имеют свои нюансы и являются более активными.
1. Для алкадиенов свойственна реакции присоединения, и они способны присоединять, как водород, так и галогены, и галогеноводороды.
Главной особенность диенов является то, что они обладают способностью присоединения не только молекулы 1,2, но и продукт присоединения 1,4:
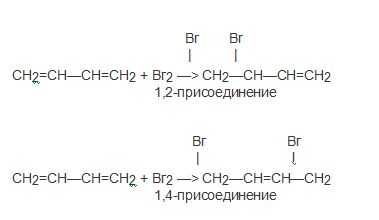
Предпочтительное протекание реакции, как правило, зависимо от условий и способа проведения.
2. Следующим химическим свойством диенов является реакции полимеризации. Она может происходить под воздействием катионов или свободных радикалов. Как правило, такая полимеризация этих соединений приводит к образованию полимеров, которые обладают свойствами, напоминающими природный каучук. Поэтому можно сказать, что основной областью применения бутадиена и изопрена, является получение синтетического каучука.

Изомерия алкадиенов с сопряженной связью
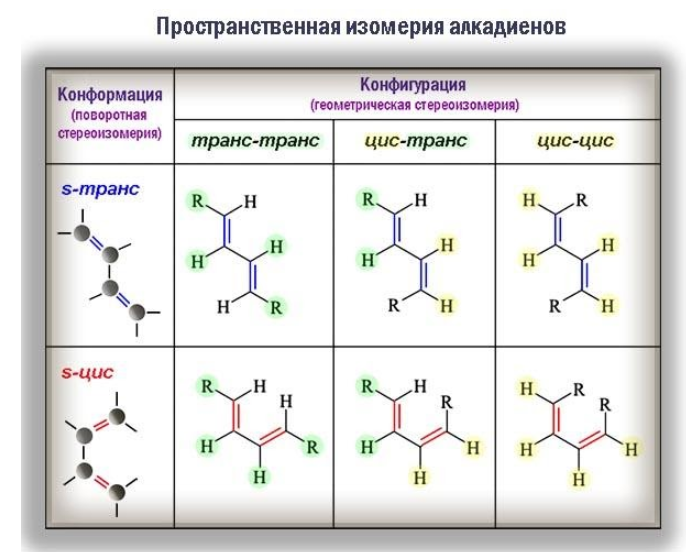
Диены образуют как структурные, так и пространственные изомеры.
Структурная изомерия
Диеновые молекулы могут различаться по следующим признакам:
Позиция сопряженной связи:
гексадиен-1,3 гексадиен-2,4 .
Строение углеродного скелета:
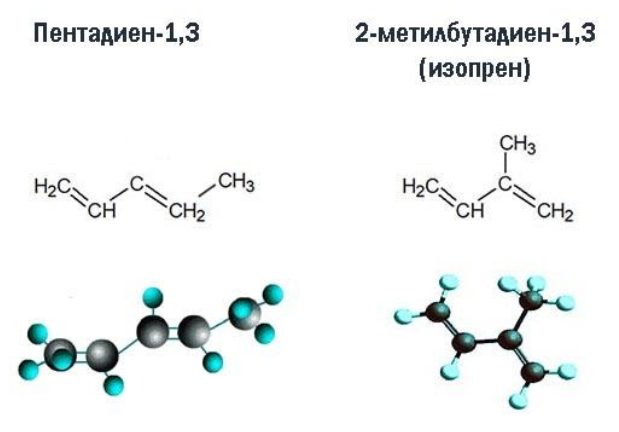
наличие соединений других классов, имеющих тот же атомный состав, – межклассовых изомеров. К их числу относятся алкины и циклоалкены.
Пространственная изомерия
Стереоизомерия (геометрические различия) возникает вследствие того, что фрагменты молекулы не могут вращаться вокруг кратной связи. Одинаковые заместители при этом оказываются либо по одну сторону от плоскости π-связи (цис-изомеры), либо по разные (транс-изомеры) и оказать влияние на реакционную способность.
Большое значение имеет и конформация молекул. Так, при вращении молекулы вокруг -связи, объединяющей сопряженную систему –C=C–C=C–, возникают поворотные (конформационные) изомеры:
- цисоиды, или заслоненные конформеры, в которых радикалы одного типа в торцевой проекции налагаются друг на друга;
- трансоиды, или заторможенные конформеры, одинаковые радикалы которых разведены на максимальное расстояние.
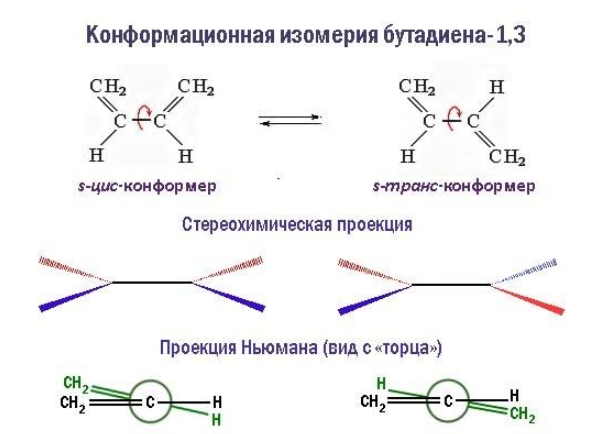
В то время как геометрическая изомерия связана с неизменной конфигурацией углеводородной молекулы, поворотные изомеры способны переходить из одного состояния в другое.
В трансоидной конформации молекула диена обладает минимальной энергией и вследствие этого менее реакционноспособна. Определенные химические превращения, например реакции диенового синтеза, протекают избирательно только с участием s-цис-конформера.
Реакция Дильса-Адлера бутадиен-1,3 этен циклогексен дивинил этилен .
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Химические свойства
Реакционная способность обусловлена определением положения двойной связи в молекуле диена. Атомы присоединяются в местах разрыва двойных связей, образуя 1,4-, 1,2-, 1,3-присоединение и т.д. В результате одних и тех же реакций образуются разные структурные соединения. Основные свойства диеновых углеводородов представлены в таблице.
|
Реакция |
Описание |
Уравнение |
|
Гидрирование |
Реакция протекает в присутствии катализатора – никеля |
CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3 |
|
Галогенирование |
Присоединение галогенов с образованием тетрагалогеноалканов |
CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br |
|
Гидрогалогенирование |
Присоединение галогеноводородов аналогично реакции с алканами. Реакция протекает в водной или спиртовой среде в присутствии хлорида лития |
CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br |
|
Полимеризация |
Реакция используется для получения искусственного каучука |
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n |
Рис. 3. Искусственный каучук.
Что мы узнали?
Из урока химии 10 класса узнали, что такое алкадиены или диеновые углеводороды. Диены отличаются от других классов ненасыщенных углеводородов наличием двух двойных связей, которые могут располагаться у одного атома углерода, через одинарную связь или через несколько простых связей. Гомологический ряд образует пропадиен. Простейшие диены – пропадиен и бутадиен – газы, диены С5-С17 – жидкости, высшие диены – твёрдые соединения. Начиная с пентадиена, диеновые углеводороды имеют изомеры. Соединения реагируют с галогенами, водородом, галогеноводородами, а также образуют полимеры.
-
/10
Вопрос 1 из 10
Алкины
Алкины также называют ненасыщенными углеводородами, так как присутствует одна тройная связь и характерны реакции присоединения.
Общая формула: CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании тройной связи находятся в состоянии sp-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения тройной связи, межклассовая изомерия с алкадиенами.
Физические свойства
Физические свойства алкинов практически не отличаются от свойств соответствующих алканов и алкенов (С2–С4 – газы, С4–С16 – жидкости при нормальных условиях, далее – твердые вещества). Температуры кипения алкинов несколько выше, чем у соответствующих алкенов (несмотря на несколько меньшую молекулярную массу). Это также связано с большей полярностью связей, образованных sp-гибридизованными атомами углерода.
Химические свойства
По своим химическим свойствам алкины похожи на алкены. Для них также наиболее характерными являются реакции электрофильного присоединения. Для несимметричных алкинов, как и для алкенов, действует правило Марковникова. Существенным отличием является меньшая реакционная способность тройных связей по сравнению с двойными. Поскольку в результате присоединения обаразуется замещенный алкен (с более реакционно-способной связью), то при избытке присоединяющегося реагента реакция, как правило, идет дальше и образуется замещенный алкан:
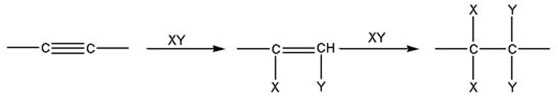 |
или |
| Алкин | Замещеный алкен | Замещеный алкан |
Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая p-связь), а затем алканов (разрывается вторая p-связь):
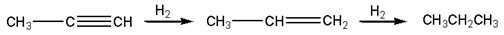 |
| Пропин | Пропен | Пропан |
При использовании менее активного катализатора гидрирование останавливается на стадии образования алкенов.
Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая). Алкины обесцвечивают бромную воду:
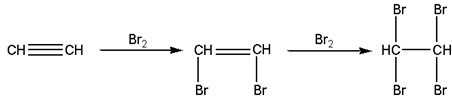 |
| Ацетилен | 1,2-Дибромэтилен | 1,1,2,2-Тетробромэтилен |
Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова :
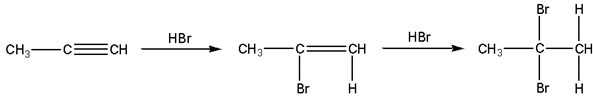 |
| Пропин | 2-Бромпропен | 2,2-Дибромпропан |
Гидрохлорирование
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида. Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
(реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена) или в кетон (в случае других алкинов).
Полимеризация
1.Димеризация под действием водно-аммиачного раствора CuCl.
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского).
Возможно образование молекул, содержащих большее число звеньев ацетилена как циклического, так и линейного строения
… –СН=СН–СН=СН–СН=СН–…
(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин (третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl.
Получение
Получение алкинов чаще всего производится по следующим реакциям:
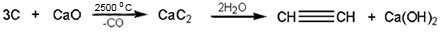 |
| Карбид кальция | Ацетилен |
Алкины могут быть получены из соответствующих галогензамещенных алканов и алкенов.
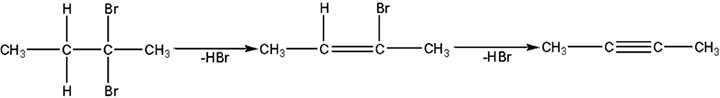 |
| 2,2-Дибромбутан | 2-Бромбутен-2 | Бутин-2 |
 |
| Бутен-1 | 1,2-Дибромбутан | Бутин-1 |
Применение
Ранее (а иногда и сейчас) ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло его применение для целей органического синтеза. Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан:
СН≡СН+2Сl2 = СНСl2–СНСl2,
а отщеплением от последнего молекулы хлороводорода – 1,1,2-трихлорэтен:
СНСl2–СНСl2 = СНСl=ССl2+НСl.






























