2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |
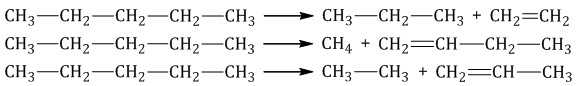
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
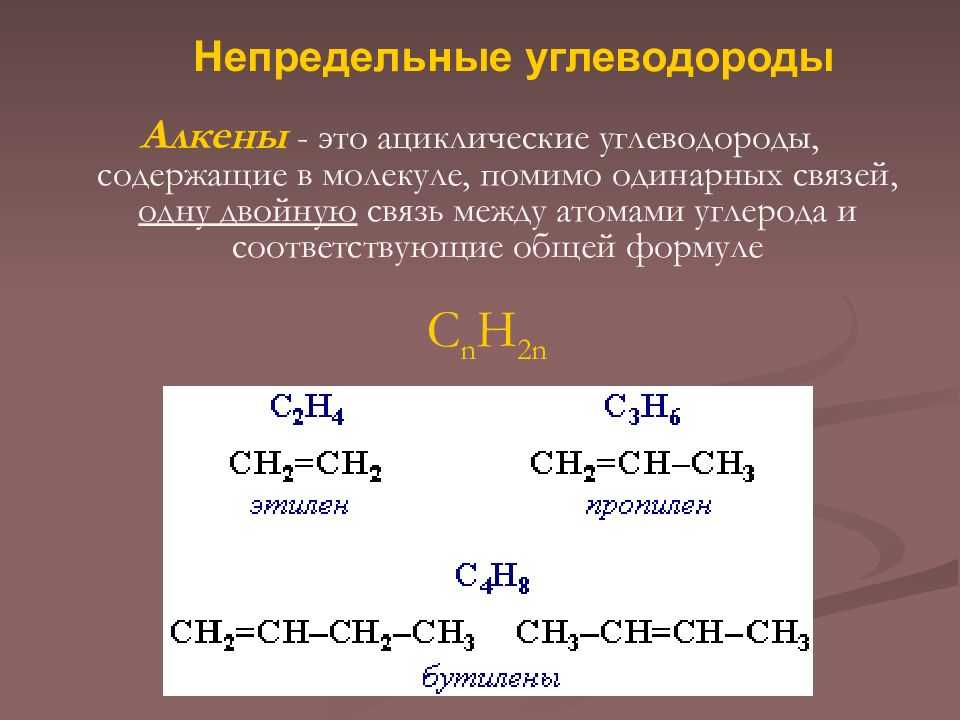
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
| Бутен-1 | Метилпропен |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2
| Бутен-1 | Бутен-2 |
Топ вопросов за вчера в категории Химия
Химия 20.06.2023 14:08 3908 Сапалов Андрей
№1. Определить валентность элементов в веществах. SiH4. CrO3. H2S. CO2. CO. SO3. SO2. Fe2O3. FeO.
Ответов: 1
Химия 19.07.2023 05:16 87 Malishava Tamriko
УМОЛЯЮ Растворимость сульфата натрия в 100 г воды при 20*С составляет 19,2 г, а при 30*С — 40.8 г. В
Ответов: 2
Химия 04.07.2023 11:21 291 Геленджик Маняня
Подсчитай, сколько теплоты выделяется при сгорании 5 моль углерода, если термохимическое уравнение
Ответов: 2
Химия 18.05.2023 16:56 1443 Амангелды Моля
Определить валентность: FeS, Al2S3, SCl2, SCl4, CO, CO2, Na3P, Ca3P2
Ответов: 2
Химия 30.06.2023 07:59 659 Шакуров Егор
Составьте формулы по валентности: ClO, AlS, PCl, PH, NaO, SO, ZnO, КS, CF,, NO, MgN, FeCl. 2. Опре
Ответов: 2
Химия 20.06.2023 08:33 326 Гарманова Даша
20 б! Практическая работа по химии(9 класс) 1. Докажите опытным путём состав: а) Серной кислоты; б
Ответов: 1
Химия 04.06.2023 01:57 227 Смирнова Наталья
Укажите, при взаимодействии каких веществ происходит реакция ионного обмена с выделением углекислого
Ответов: 1
Химия 03.10.2023 07:48 471 Коряшкин Максим
1. Найдите массу 1,5*1026 молекул оксида железа (II) FeO.
Ответов: 2
Химия 18.07.2023 12:21 651 Афанасьев Данил
Определить массу одной молекулы воды (H20, M=18г/моль) Помогите пожалуйста!!
Ответов: 3
Химия 04.07.2023 04:40 967 Кривич Алексей
Вопрос Верны ли следующие суждения об условиях протекания реакций ионного обмена? А. Если в раство
Ответов: 2
Реакции окисления алкенов
Как и любые органические соединения, алкены горят в кислороде с образованием СO2 и Н2O:
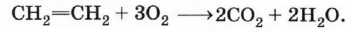
В общем виде:
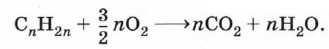
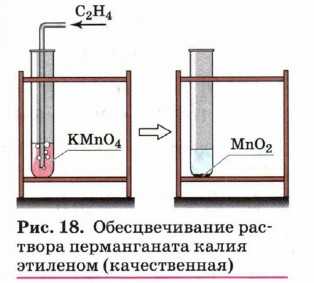
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием водных растворов перманганата калия (рис. 18). В нейтральных или слабощелочных растворах на холоду происходит окисление алкенов до диолов (двухатомных спиртов), причём гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
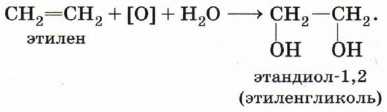
В действительности процесс окисления алкенов гораздо сложнее, происходящие при этом превращения можно отобразить уравнением:
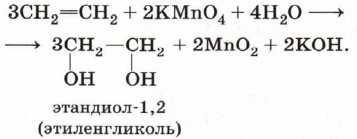
В кислой среде (подкисленный серной кислотой раствор) при нагревании происходит полное разрушение двойной связи и превращение атомов углерода, между которыми существовала двойная связь, в атомы углерода карбоксильной группы:
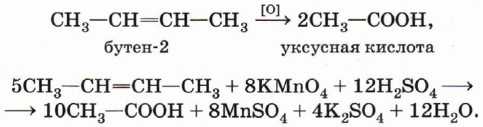
Если двойная связь находится у конца молекулы (например, в случае бутена-1), то одним из продуктов окисления должна оказаться муравьиная кислота — вещество, которое легко окисляется до углекислого газа и воды:
Если в молекуле алкена атом углерода при двойной связи содержит два углеводородных заместителя (например, 2-метилбутен-2), то при его окислении происходит образование кетона, так как превращение такого атома в атом карбоксильной группы невозможно без разрыва С—С-связи, относительно устойчивой в этих условиях:
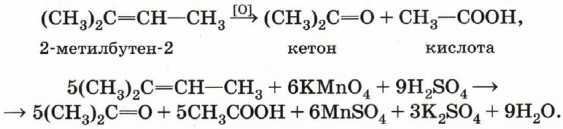
Деструктивное окисление алкенов можно применять для определения их структуры. Так, например, если при окислении некоторого алкена получены уксусная и пропионовая кислоты:
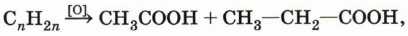
это означает, что окислению подвергся пентен-2:
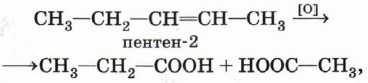
а если получены масляная (бутановая) кислота, углекислый газ и вода:
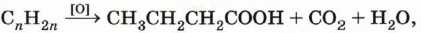
то исходный углеводород — пентен-1:
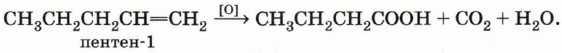
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
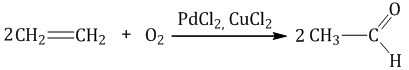
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
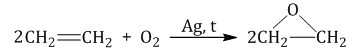
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
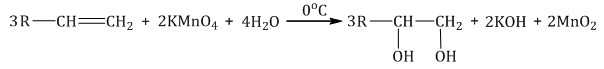
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
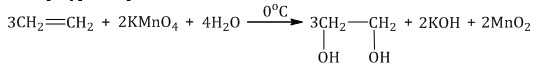
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
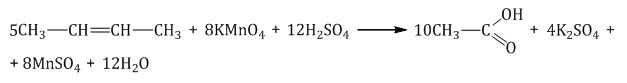
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
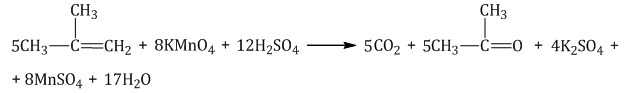
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, п ри окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |

| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
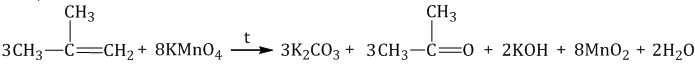
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.

При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |

4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
| Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен |

Применение алкенов
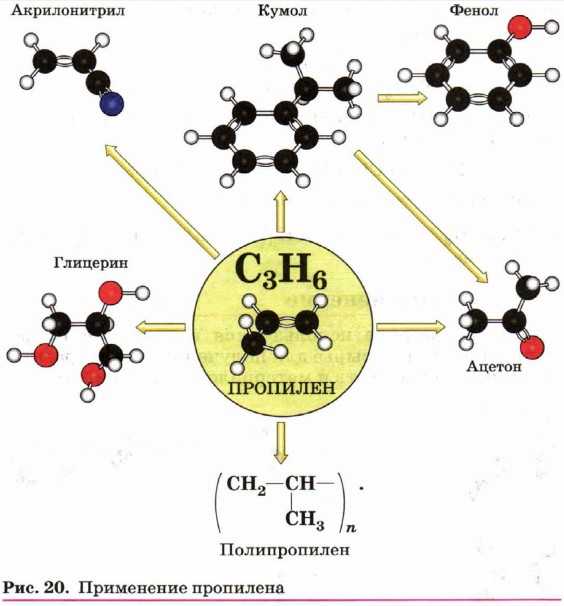
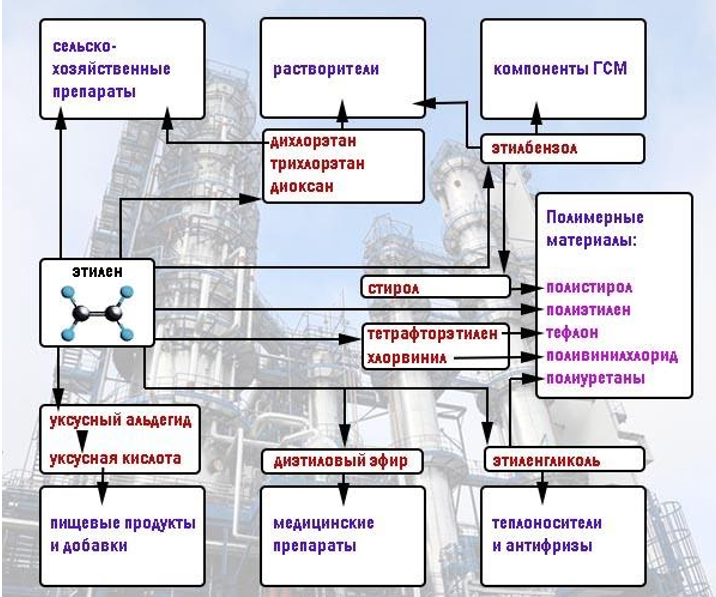
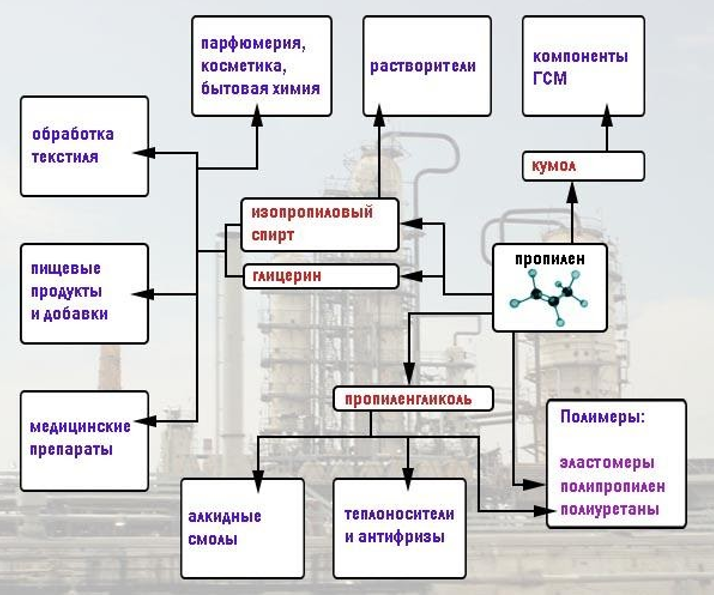
Алкены широко используются в химической промышленности как сырьё для получения разнообразных органических веществ и материалов (рис. 19 и 20).
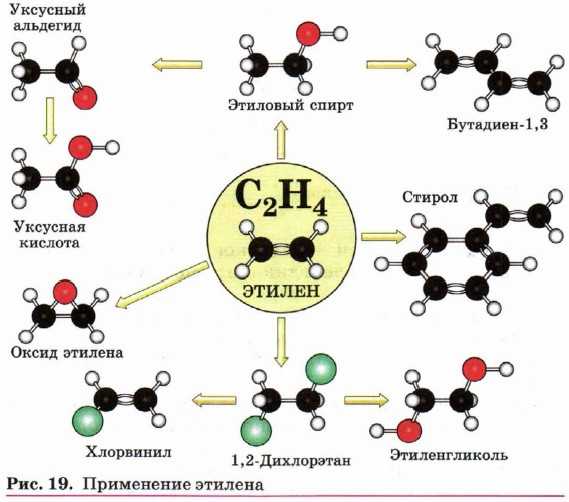
Так, например, этен — исходное вещество для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.
Большое количество этена перерабатывается в полиэтилен, который используется для изготовления упаковочной плёнки, посуды, труб, электроизоляционных материалов.
Из пропена получают глицерин, ацетон, изопропиловый спирт, растворители. Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена — одно из самых прочных синтетических волокон.
Материалы, изготовленные из этих волокон, являются перспективными и находят всё большее применение в разных областях человеческой деятельности.

1. Какие виды изомерии характерны для алкенов? Напишите формулы возможных изомеров пентена-1.
2. Из каких соединений может быть получен: а) изобутен (2-метилпропен); б) бутен-2; в) бутен-1? Напишите уравнения соответствующих реакций.
3. Используя рисунок 20, перечислите области применения пропилена.
4. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б, В:
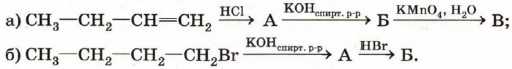
5. Предложите способ получения 2-хлорпропана из 1-хлорпропана. Напишите уравнения соответствующих реакций.
6. Предложите способ очистки этана от примесей этилена. Напишите уравнения соответствующих реакций.
7. Приведите примеры реакций, с помощью которых можно различить предельные и непредельные углеводороды.
8. На полное гидрирование 2,8 г алкена израсходовано 0,896 л водорода (н. у.). Какова молекулярная масса и структурная формула этого соединения, имеющего нормальную цепь углеродных атомов?
Ответ: 70.
9. Какой алкен находится в цилиндре, если известно, что на полное сгорание 20 см3 этого газа потребовалось 90 см3 (н. у.) кислорода?
Ответ: пропен.
10. При реакции алкена с хлором в темноте образуется 25,4 г дихлорида, а при реакции этого алкена той же массы с бромом в тетрахлорметане — 43,2 г дибромида. Установите все возможные структурные формулы исходного алкена.
11. Разделите лист бумаги пополам вертикальной чертой. Слева напишите 5 структурных формул алкенов, содержащих от 5 до 10 атомов углерода. Справа напишите названия этих углеводородов. Разрежьте лист по черте, передайте половинки двум одноклассникам, получите от них аналогичные половинки листков. Допишите по полученным формулам названия алкенов, по названиям — формулы. Проведите взаимопроверку.
12. Что такое сополимеры? При формулировании ответа на вопрос воспользуйтесь сайтом: http://www.xumuk.ru/encyklopedia/2/4145.html. Составьте уравнение реакции сополимеризации этилена и стирола.
Области применения алкенов
В качестве химического сырья или конечного продукта алкены широко востребованы в промышленности.

Синтез полимеров
Из этилена и его производных получают полиэтилен, тефлон (политетрафторэтилен), полистирол, поливинилхлорид; из пропилена – полипропилен. Этилен и пропиленгликоли, получаемые окислением соответствующих алкенов, используются в производстве полиуретанов.
Из этилен-пропиленовых эластомеров изготавливают резины и изоляционные материалы. Бутен (бутилен) представляет собой сырье для получения изопрена, бутадиена, изобутилена, продуктами полимеризации которых являются каучуки.
Производство горюче-смазочных материалов и антифризов
В качестве добавок к бензинам применяются:
- этилбензол;
- изопропилбензол, или кумол (получают на основе пропена);
- изооктан (синтезируют с использованием бутена).
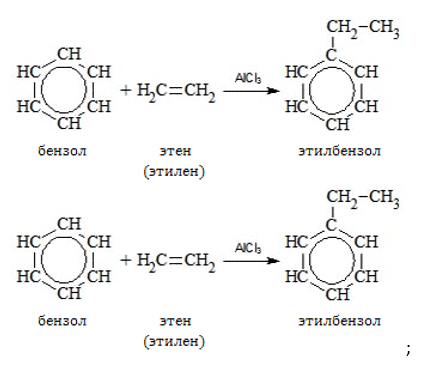
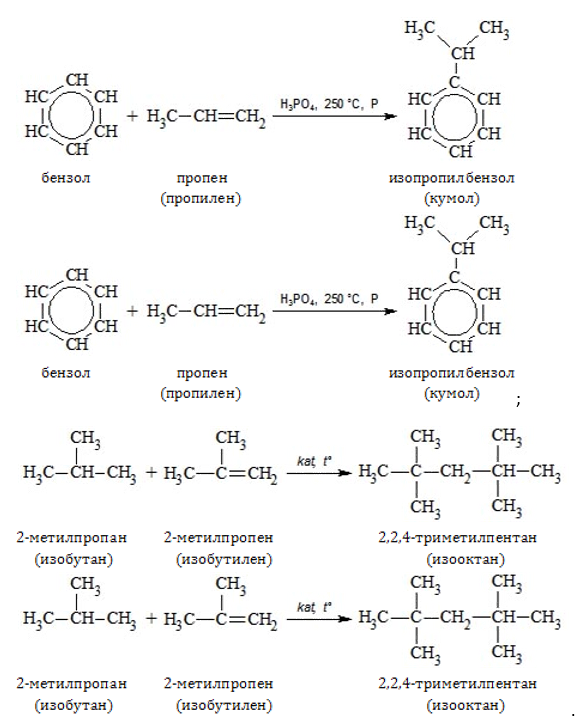
Производные этилена и изобутилена входят в состав машинных масел. Многоатомные спирты этиленгликоль и пропиленгликоль используются как основа для антифризов.
Бутилен содержится в газовых смесях для сварки и резки металлов.
Производство растворителей
Этилен служит сырьем для синтеза диоксана, дихлорэтана и трихлорэтилена – органических растворителей широкого назначения.
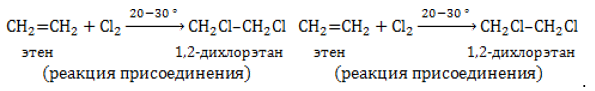
Другой распространенный растворитель – бутанон, или метилэтилкетон – получают из бутена.
Сельское хозяйство
Дихлорэтан применяют также для обеззараживания семян и помещений сельскохозяйственного назначения. В сельском хозяйстве используется и непосредственно этилен как растительный гормон, особенно в качестве стимулятора роста и созревания плодов.
Фармацевтическое производство
Широкое применение в медицине находят производные пропена – изопропанол и глицерин как эффективные антисептики, компоненты препаратов для лечения кожных заболеваний и растворители. Глицерин также предотвращает высыхание вязких препаратов – мазей, паст – и способствует увеличению срока их годности. Он входит в состав противоожоговых и противокашлевых средств.
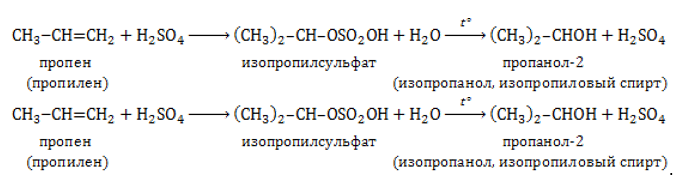
Получаемый из этилена диэтиловый эфир применяется в медицинской практике как препарат для общего наркоза и местной анестезии.
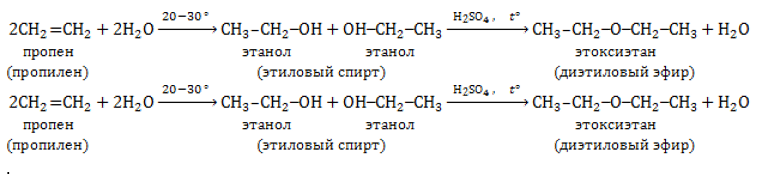
Пищевая и легкая промышленность
Путем окисления этилена на катализаторе получают уксусный альдегид, являющийся сырьем для производства уксусной кислоты.
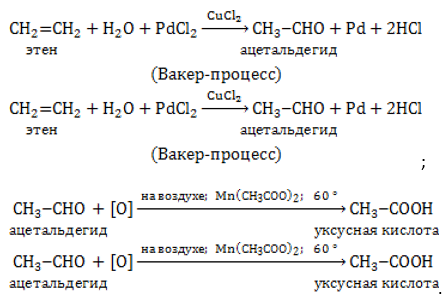
Глицерин зарегистрирован в качестве эмульгатора, защитного пленкообразователя и загустителя как пищевая добавка E422. Наряду с изопропиловым спиртом входит в состав косметической и парфюмерной продукции и бытовой химии.
Текстильная промышленность также использует глицерин для обработки волокон и тканей.
Алкены состава
Разнообразие сфер применения алкенов и их производных можно представить в схематическом виде:
Получение алкеновых углеводородов
Главный источник сырья для алкенов – предельные углеводороды, выделяемые из нефти, нефтяных попутных газов и природного газа, а также их производные.
Основные способы получения алкенов в промышленности
Процесс пиролиза (термического разложения) высокомолекулярных алканов и циклоалканов проводится при
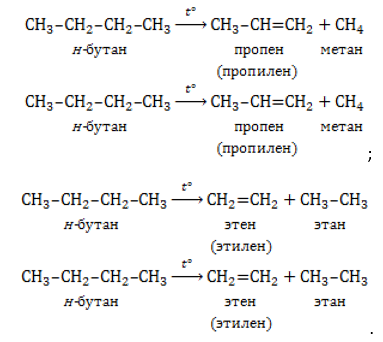
Пиролиз – распространенный способ получения наиболее востребованных алкенов – этилена и пропилена.
Отличие крекинга от пиролиза состоит в более низкой рабочей температуре процесса (450 — 550℃ 450 — 550℃) и в большей длительности, однако при этом требуется повышенное давление
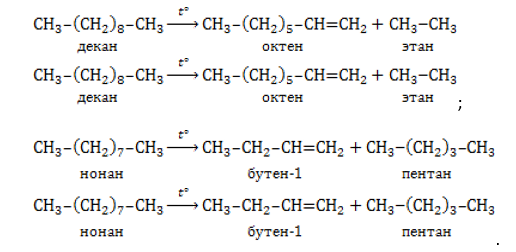
Крекингом нефти и газойля получают значительную часть бутилена, изобутилена и более высокомолекулярных алкенов.
При термической обработке каменного угля образуется коксовый газ, содержащий этилен. В ряде случаев его выделение оказывается экономически выгодным и производится в промышленных масштабах.
Нагревание алканов до
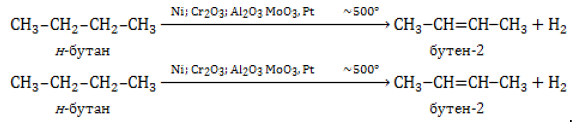
Лабораторный синтез алкенов
Алкены получают в лаборатории с помощью таких методов, как:
Отщепление гидроксогруппы OHOH и водорода HH от молекулы спирта протекает при 150℃ и выше в присутствии сильного водопоглощающего агента, например, концентрированной серной или фосфорной кислоты:
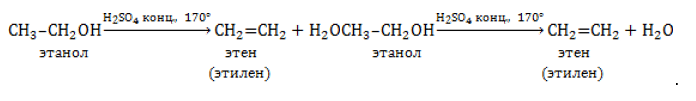
Данный способ может применяться и для промышленного синтеза в том случае, если стоимость этанола, получаемого из сельскохозяйственного сырья, оказывается ниже, чем у нефтепродуктов.
Дегалогенирование и дегидрогалогенирование галогенпроизводных алканов.
Если в дигалогеналкане галогенизированы атомы углерода, расположенные в молекулярной цепочке рядом, они могут быть отщеплены с образованием алкена цинком либо другим активным металлом – магнием:
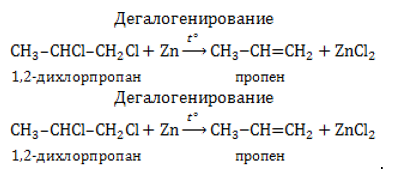
От молекулы моногалогеналкана возможно отнятие водорода и галогена щелочью, растворенной в спирте. В результате отщепления в молекуле возникает двойная связь:
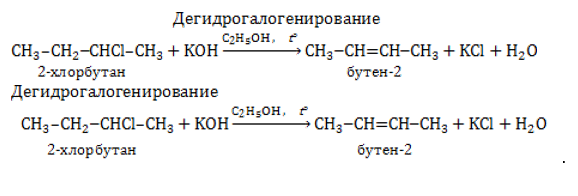
Водород отщепляется от наименее гидрированного углеродного атома в молекуле галогеналкана (правило Зайцева).
В присутствии специального катализатора Линдлара алкины гидрируются до алкенов:
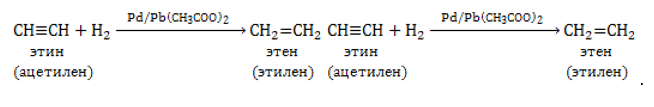
Полное гидрирование приводит к образованию алканов.
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
| Например, алкен имеет название 2-метилпропен. |
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
| Тривиальное название | Формула алкена |
| Этилен | |
| Пропилен | |
| Бутилен-1 |
Радикалы, содержащие двойную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH 2 =CH- | винил |
| CH2=CH-CH2— | аллил |
Последние заданные вопросы в категории Химия
Химия 22.10.2023 05:25 25 Хузиахметова Дилярка
найдите концентрацию растворов в процентах если масса насыщенного раствора 200 г а коэффициент раств
Ответов: 1
Химия 22.10.2023 05:25 22 Llorens Natasha
Любий видатний український хімік, конкретно розповісти що він створювавДопоможіть будь ласка
Ответов: 1
Химия 22.10.2023 05:25 30 Лягуша Данил
Что обозначают цифры рядом с изотопами?
Ответов: 1
Химия 22.10.2023 05:25 8 Обоимов Александр
Розпишіть все будь ласка
Ответов: 2
Химия 22.10.2023 05:25 3 Марченко Дарья
Задание: Используя графический метод анализа данных, представьте информацию по теме «Мой дом» ДАМ 30
Ответов: 1
Химия 22.10.2023 05:24 22 Миронова Анастасия
Указать тип химических реакций, расставить коэффициенты. P+O2=P205 H2O2= H2O +02Ca+O2=CaOZn+CuSO4=
Ответов: 1
Химия 22.10.2023 05:21 4 Хариш Таня
Якою стане масова частка солі в розчині якщо до 200г 30% розчину долили 200г води
Ответов: 1
Химия 22.10.2023 05:16 7 Коваленко Катюша
Терміново допоможіть будь ласка Заверш рівняння реакції та урівняй, вкажи його тип та запиши класи
Ответов: 2
Химия 22.10.2023 05:16 9 Юрченко Тая
Названия и формулы оксидных, сульфатных, хлоридных, карбонатных минералов
Ответов: 1
Химия 22.10.2023 05:15 12 Бойко Даниил
Задача на 100 балов!!!! Яка маса 9% розчину етанової кислоти витратиться на взаємодію з 112 г к
Ответов: 2