Кто открыл строение вещества
Задолго до конца XIX века было хорошо известно, что приложение высокого напряжения к газу, содержащемуся при низком давлении в герметичной трубке (называемой газоразрядной трубкой), вызывало протекание электричества через газ, который затем излучал свет. Исследователи, пытающиеся понять это явление, обнаружили, что катод, или отрицательно заряженный электрод, также излучает необычную форму энергии; эта форма энергии была названа катодным лучом.
В 1897 году британский физик Дж. Дж. Томсон (1856-1940) доказал, что атомы не являются основной формой материи. Он продемонстрировал, что катодные лучи могут отклоняться магнитными или электрическими полями. Это означало, что катодные лучи состоят из заряженных частиц.
Схема электронно-лучевой трубки с отклонением.
Электроды генерируют луч. Другой набор электродных пластин отклоняет луч, при этом луч изгибается в сторону положительной пластины.
Что еще более важно, измеряя степень отклонения катодных лучей в магнитных или электрических полях различной силы, Томсон смог рассчитать отношение массы частиц к заряду. Эти частицы испускались отрицательно заряженным катодом и отталкивались отрицательным выводом электрического поля
Поскольку одинаковые заряды отталкивают друг друга, а противоположные заряды притягиваются, Томсон пришел к выводу, что частицы имеют чистый отрицательный заряд. Теперь эти частицы называются электронами. Томсон обнаружил, что отношение массы к заряду катодных лучей не зависит от природы металлических электродов или газа. Это позволило ему предположить, что электроны являются фундаментальными компонентами всех атомов.
Когда катодные лучи движутся вправо, они отклоняются в сторону положительного электрода (+), демонстрируя, что они заряжены отрицательно.
Впоследствии американский ученый Роберт Милликен (1868–1953) провел серию экспериментов с использованием электрически заряженных капель масла, что позволило ему рассчитать заряд на одном электроне. Используя эту информацию и отношение массы к заряду Томсона, Милликен определил массу электрона:
Именно в этот момент начали сходиться два отдельных направления исследований, оба из которых были направлены на определение того, как и почему материя излучает энергию.
Строение вещества
- Подробности
- Обновлено 17.08.2018 14:30
- Просмотров: 733
Все вещества состоят из отдельных мельчайших частиц : молекул и атомов.
Основоположником идеи дискретного строения вещества (т.е. состоящего из отдельных частиц) считается древнегреческий философ Демокрит, живший около 470 года до новой эры. Демокрит считал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц. «Они бесконечно разнообразны, имеют впадины и выпуклости, которыми сцепляются, образуя все материальные тела, а в природе существуют только атомы и пустота.
Догадка Демокрита была надолго забыта. Однако, его взгляды на строение вещества дошли до нас благодаря римскому поэту Лукрецию Кару: «… все вещи, как мы замечаем, становятся меньше, И как бы тают они в течение долгого века…»
Атомы
Атомы очень малы. Их невозможно разглядеть не только простым глазом, но и с помощью даже самого мощного оптического микроскопа.
Глаз человека не способен разглядеть атомы и промежутки между ними, поэтому любое вещество кажется нам сплошным.
В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру металла.
Атомы различных химических элементов отличаются друг от друга. Различия атомов элементов можно определить по периодической таблице Менделеева.
Молекулы
Молекула — это мельчайшая частица вещества, обладающая свойствами этого вещества. Так, молекула сахара — сладкая, а соли — соленая.
Молекулы состоят из атомов.
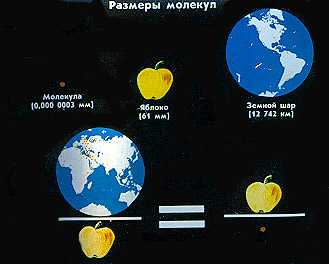
Размеры молекул ничтожно малы.
Как увидеть молекулу? — с помощью электронного микроскопа.
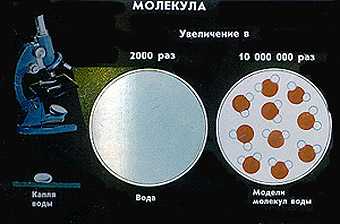
Как добыть молекулу из вещества? — механическим дроблением вещества.
Каждому веществу соответствует определеенный вид молекул. У разных веществ молекулы могут состоять из одного атома (инертные газы) или из нескольких одинаковых или различных атомов, или даже из сотен тысяч атомов (полимеры). Молекулы различных веществ могут иметь форму треугольника, пирамиды и других геометрических фигур, а также быть линейными.
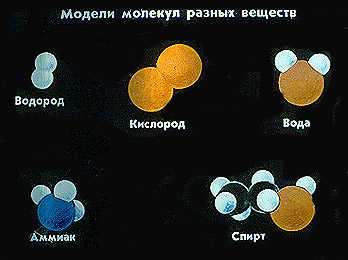
Молекулы одного и того же вещества во всех агрегатных состояниях одинаковы.
Между молекулами в веществе существуют промежутки. Доказательствами существования промежутков служат изменение объема вещества, т.е. расширение и сжатие вещества при изменении температуры, и явление диффузии. Молекулы вещества находятся в непрерывном тепловом движении.
КНИЖНАЯ ПОЛКА
С чем едят тефлон? ………. смотреть
Инопланетное чудо ………. смотреть
Что тоньше всего? ………. смотреть
Движущаяся ракета ………. смотреть
Расходящиеся кольца ………. смотреть
НЕУЖЕЛИ?
Если бы размер молекулы увеличить до размера точки в конце предложения в книге, то толщина человеческого волоса стала бы равна 40м, а человек, стоя на поверхности Земли, упирался бы головою в Луну!
Если из детского резинового шарика, надутого и наполненного водородом (массой 3г), каждую секунду выпускать по 1 миллиону молекул, то понадобится 30 миллиардов лет!
Если удалить пространство из всех атомов человеческого тела, то все, что останется, сможет пролезть через игольное ушко.
ВЕСЁЛЫЕ ЗАДАЧКИ!
— жми здесь!
ПОЧЕМУ?
1. Рука золотой статуи в древнегреческом храме, которую целовали прихожане, за десятки лет заметно похудела. Почему?
2. Почему появляются углубления в ступенях древних каменных лестниц?
3. Почему изнашиваются подметки у ботинок, и стираются до дыр локти пиджаков?
4. Чем отличается движение одной и той же молекулы в воздухе и в вакууме?
ОПРЕДЕЛЕНИЕ РАЗМЕРОВ МАЛЫХ ТЕЛ МЕТОДОМ РЯДОВ
Если вам необходимо определить размеры очень маленького тела (хотя бы макового зернышка), и осуществить это с помощью измерительных приборов (например, линейки) невозможно, следует прибегнуть к «методу рядов».

Расположите некоторое количество тел вплотную друг к другу в ряд, измерьте длину ряда и рассчитайте по формуле размер «l» одного тела.
N — количество тел в ряду
L — длина ряда
Проверьте, не поленитесь, это очень удобно!
Следующая страница
Назад в раздел «Занимательные фишки по физике для 7 класса»
Значение для науки и технологий
Понимание дискретного строения вещества имеет огромное значение для различных научных и технологических областей. Вот некоторые из них:
- Физика и химия: Дискретное строение вещества является основой для многочисленных теорий и моделей, которые объясняют поведение и свойства веществ. Изучение дискретных элементов, таких как атомы и молекулы, помогает улучшить наши знания о физических и химических процессах.
- Нанотехнологии: Дискретное строение вещества становится все более важным при разработке и производстве наноматериалов и наноустройств. Понимание и контроль на уровне отдельных атомов и молекул позволяет создавать новые материалы с улучшенными свойствами и функциональностью.
- Квантовая механика: Дискретные значения энергии и других физических величин, связанные с дискретным строением вещества, являются основой квантовой механики. Использование квантовой механики позволяет нам лучше понять и предсказывать поведение микрочастиц и проводить современные исследования в области квантовой вычислительной техники.
- Фармацевтическая и медицинская промышленность: Понимание дискретного строения вещества позволяет разрабатывать новые лекарственные препараты и методы лечения. Изучение взаимодействия молекул с организмом, анализ и синтез биологически активных веществ становятся возможными благодаря знаниям о дискретном уровне материи.
- Электроника и информационные технологии: В современной электронике и информационных технологиях дискретное строение вещества играет важную роль. Оно позволяет создавать идеально выровненные кристаллы, из которых состоят полупроводники, и контролировать поток электронов на уровне одиночных частиц. Это обеспечивает высокую точность и надежность работы электронных устройств.
В целом, понимание дискретного строения вещества является фундаментальным для многих научных и технологических областей и способствует развитию новых технологий и прогрессу человечества в целом.
Понятие и примеры дискретной структуры
Дискретная структура представляет собой систему, в которой элементы имеют отдельные индивидуальные значения и не подразумевают непрерывного изменения. Отличительной особенностью дискретных структур является то, что они состоят из конечного или счётного множества элементов.
Одним из примеров дискретной структуры является конечное множество, которое содержит конечное количество элементов. Например, множество {1, 2, 3, 4, 5} является конечным дискретным множеством, так как количество его элементов ограничено.
Другим примером дискретной структуры является счётное множество, которое содержит бесконечное, но перечислимое количество элементов. Например, множество натуральных чисел {1, 2, 3, …} является счётным дискретным множеством, так как его элементы можно перечислить в определённом порядке.
Дискретные структуры также используются для описания сетей и графов. Например, в графовой структуре каждый элемент представляет собой вершину, а связи между элементами образуют рёбра. Граф может быть конечным или счётным, в зависимости от количества его вершин и рёбер.
Таким образом, дискретные структуры играют важную роль в математике и информатике, позволяя описывать и анализировать объекты с дискретными значениями и связями между ними.
Как определить строение вещества
Точки плавления и кипения
Температура плавления не всегда является хорошим показателем величины притяжения между частицами, потому что силы притяжения ослабевают только при плавлении, а не полностью разрушаются. Точка кипения — гораздо лучший ориентир, потому что теперь подано достаточно тепла, чтобы полностью разрушить силы притяжения. Чем сильнее притяжение, тем выше температура кипения.
При этом точки плавления часто используются для оценки величины сил притяжения между частицами в твердых телах, но иногда обнаруживается странность. Эти странности обычно исчезают, если вместо этого вы рассматриваете точки кипения.
Влияние воды
Растворимость твердого вещества в воде (без реакции) предполагает, что оно ионное. Конечно, из этого правила есть исключения. Сахар (сахароза) растворим в воде, несмотря на то, что является ковалентной молекулой. Он способен к обширным водородным связям с молекулами воды.
И существует множество ионных соединений, нерастворимых в воде. Растворимость твердого вещества с низкой температурой плавления или жидкости в воде (без ее реакции) предполагает наличие небольшой молекулы, способной образовывать водородные связи, или по крайней мере — небольшой очень полярной молекулы.
Проводимость электроэнергии
Проводимость электричества в твердом состоянии предполагает делокализованные электроны и, следовательно, это либо металл, либо графит.
Внешность
Большинству металлов свойственны блестящий внешний вид и простота их обработки. Металлы податливы (легко поддаются изгибу или приданию формы) и пластичны (могут быть вытянуты в проволоку). Напротив, гигантские ионные или гигантские ковалентные структуры, как правило, хрупки — разрушаются, а не изгибаются.
Агрегатные состояния вещества
При изучении основных положений о строении вещества в 7 классе на уроках физики им даются четкие определения, которые затем можно использовать в рефератах на эту тему. Основной принцип: любое из них состоит из элементарных частиц, расположенных на разных расстояниях. Это означает, что между молекулами существуют промежутки. Их величина зависит от агрегатного состояния вещества.
Проще всего понять строение вещества на физике в 7 классе по таблице:
| Агрегатное состояние | Расположение в пространстве молекул | Особенности движения | Расстояние между соседними молекулами |
| Твердое | Существует определенный порядок | Идет колебание без перемещения | Малое расстояние, меньше диаметра молекулы |
| Жидкое | Хаотичное | Идут колебания с перемещением | Расстояние меньше, чем размер молекулы |
| Газообразное | Хаотичное | Постоянно происходят удары и перемещения | Большое расстояние, на этом отрезке может расположиться множество молекул |
В природе вещества встречаются во всех трех агрегатных состояниях. Каждые их них имеют свои характеристики.
Твердые тела
Следует знать, что в твердых телах молекулы расположены близко друг к другу. При этом они лишены возможности перемещения. Твердые вещества разделяются на 2 группы:
- Аморфные. Расположение мельчайших частиц ведется в хаотичном порядке. Здесь не прослеживается четкой структуры.
- Кристаллические. В таких телах расположение молекул идет по определенной схеме.
В зависимости от структуры решетки кристаллические твердые тела разделяются на 4 типа. Их описание носит следующий характер:
- Атомные. Мельчайшие частицы в таких веществах прочно связаны между собой. В итоге тела отличаются повышенной прочностью. Примером может служить алмаз.
- Молекулярные. Здесь связи между частицами ослаблены. В результате тела легко подвергаются плавлению. В качестве примера можно привести сахар.
- Ионные. В узлах кристаллической решетки таких тел находятся положительно и отрицательно заряженные частицы. Связываются они между собой при помощи электростатического притяжения. К таким веществам относятся хорошо растворимые в воде кислоты и щелочи.
- Металлические. Здесь в узлах кристаллической решетки располагаются положительные ионы. Между ними свободно перемещаются отрицательные электроны. Поэтому такие тела хорошо проводят электрический ток и тепловую энергию.
Кристаллическое строение вещества относится к устойчивой структуре. Причина состоит в том, что в ней присутствует небольшое количество потенциальной энергии.
Особенности жидкости
Молекулы жидкости не составляются такую же четкую структуру, какая существует в твердых телах. При этом они располагаются достаточно близко друг к другу. Расстояние между частицами является величиной постоянной. Это обеспечивается достаточно высокой молекулярной связью. Однако ее силы недостаточно, чтобы молекулы находились в статическом положении на протяжении длительного времени. В результате происходит их перескакивание в другие места. Как результат, жидкость обладает свойством текучести.
Самая распространенная в природе жидкость — это вода. Однако в зависимости от типа мельчайших частиц существуют другие разновидности жидких веществ:
- Атомарные. В их состав входят атомы и сферические молекулы. Примером служит метан.
- Двухатомные. Их состав состоит из двух одинаковых атомов. Сюда относится ртуть, жидкий водород.
- Полярные. Состоят из полярных молекул. Пример — жидкий бромводород.
- Ассоциированные. Между частицами присутствуют водородные связи. Это обычная вода.
Благодаря особенностям внутренней структуры жидкости способны растворять в себе некоторые вещества.
Газообразная структура
В газообразных телах молекулы располагаются на больших расстояниях друг от друга. В результате между ними не наблюдается взаимодействия. Если газ поместить в закрытый сосуд, то он быстро распространится по всему объему. Из-за большого расстояния между мельчайшими частицами газообразные тела легко сжимаются.
Некоторые тела обладают возможностью переходить из одного агрегатного состояния в другое. Примером может служить вода, которая при испарении превращается в газ. Особенно быстро этот процесс происходит при ее кипении. В этот период от нее отрываются молекулы, большое количество которых формирует пар.
Рассматривая любое тело, находящееся в каком-либо агрегатном состоянии, следует понимать, что основой его являются микроскопические частицы — молекулы и атомы. Только в зависимости от расположения их в пространстве каждое вещество приобретает индивидуальные ему свойства.
Атомы и молекулы
Атом — это неделимая частица вещества, состоящая из электронов, протонов и нейтронов.
Молекула — это частица вещества, состоящая из двух или более атомов, объединенных химическими связями.
Атомы и молекулы играют важную роль в химии и физике. Они определяют химические свойства вещества и его физические свойства, такие как теплоемкость и плотность. Атомы и молекулы также влияют на химические реакции и взаимодействия.
Атомы различных элементов имеют разное количество электронов, протонов и нейтронов. Это определяет их химические свойства и способность образовывать химические соединения. Молекулы вещества образуются путем присоединения двух или более атомов через химические связи.
Для описания атомов и молекул используются различные модели, такие как модель Резерфорда и модель Шредингера. Эти модели помогают понять устройство и поведение атомов и молекул, а также предсказывать их свойства и реактивность.
Таблица Менделеева — это упорядоченная таблица элементов, где вещества располагаются в порядке возрастания атомного номера. Эта таблица позволяет систематизировать информацию о свойствах каждого элемента и предсказывать их химическое поведение.
Атомы и молекулы являются основой для понимания строения и свойств вещества. Изучение их структуры и взаимодействий позволяет разработать новые материалы, лекарства и технологии, а также понять механизмы химических реакций.
Молекулярная структура и химические связи
Молекулярная структура — основное понятие в химии, которое описывает способ расположения атомов в молекуле. Молекулы состоят из атомов, которые связаны между собой химическими связями. Химические связи обеспечивают стабильность молекулы за счет обмена или общего использования электронов между атомами.
Химические связи бывают разных типов: ионные, ковалентные и металлические. Ионная связь возникает между атомами, когда один из них отдает электроны, а другой их принимает. В результате образуются ионы с противоположными зарядами, которые притягиваются друг к другу.
Ковалентная связь формируется, когда атомы обменивают электроны и образуют общие пары электронов. В результате образуется между атомами общий область, которая удерживает их вместе. >В зависимости от числа общих пар электронов между атомами различают одинарные, двойные и тройные ковалентные связи.
Металлическая связь встречается в металлах, где кристаллическая решетка состоит из положительно заряженных ионов, образующих ионы-ядра и электронное облако. Металлическая связь возникает между свободными электронами и металлическими ионами и обеспечивает характерные свойства металлов, такие как электропроводность и теплопроводность.
Температура
Благодаря комбинациям атомов у разных веществ молекулы неодинаковы. А если рассмотреть одно вещество, но в разных ситуациях, например, воду из водопроводного крана, в кружке чая или весеннем ручейке. Во всех трех случаях молекулы одни и те же, но ведут они себя по-разному. В горячем чае молекулы движутся наиболее быстро. В холодном ручейке гораздо медленнее. А в воде из крана молекулы движутся медленнее, чем в горячем чае, но быстрее, чем в ручейке.
Конечно, речь здесь идет о таких скоростях, с которыми человек не может передвигаться. Человек может идти со скоростью 4 – 7 км/ч. Скорость молекулы воды при комнатной температуре в среднем 590 м/с = 2124 км/ч (в кипящей воде — ≈ 2340км/ч) Это надо понимать, когда говорят, что одни молекулы движутся быстро, а другие медленно.
Когда говорят «холодно», «тепло», «горячо», то сравнивают температуру. Определяется температура любого тела тем, как движутся молекулы этого тела: быстро или медленно. Температура тем выше, чем быстрее передвигаются молекулы. Если же молекулы начинают двигаться медленнее, то и температура тела понижается.
Окружающая нас природа зависит от температуры. С понижением ее приходит осень, а потом зима. С ростом температуры зима уступает место весне, а весна – лету.
Свойства вещества также зависят от температуры. Например, мягкая резина на холоде становится твердой, а твердый лед превращается в жидкость, если его занести в теплую комнату.
Температура характеризует свойства живой и неживой природы. Значит, о ней многое нужно знать. Главное надо запомнить это: скорость движения молекул, образующих вещество, определяет его температуру.
Чтобы измерить температуру, используют приборы – термометры. Термометры бывают по назначению:
- лабораторные;
- медицинские;
- уличные;
- комнатные;
- технические.
по конструкции:
- жидкостные;
- газовые;
- механические;
- электрические;
- оптические.
Температура измеряется в градусах. В 1742 году шведский геолог, метеоролог и астроном Андрес Цельсий придумал шкалу, в основе которой лежат отсчетные точки: температура таяния льда (0 градусов) и температура кипения воды (100 градусов).
(Источник)
В 1848 году Уильям Томсон (лорд Кельвин) ввел понятие абсолютного нуля температуры (-273 градуса, минимальная возможная температура во Вселенной). При этом, температура таяния льда уже 273 градуса и соответственно кипения воды 373 градуса.
(Источник)
В 1724 году польско-немецкий ученый Даниель Габриель Фаренгейт создал свою шкалу, которая использовала в англоязычных странах. Сейчас она используется только в США.
(Источник)
На всех трех шкалах используются две основные точки – температуры перехода выбранного вещества из одного состояния в другое.
На шкалах Цельсия и Кельвина этим веществом выбраны вода, а две точки – это температура таяния льда и кипения воды. Промежуток между этими температурами разделен на 100 частей, таким образом получен 1 градус.
Цельсий выбрал за 0о температуру плавления льда. Кельвин обозначил нулем минимальную возможную температуру (когда движение молекул прекращено). Тогда по Цельсию лед плавится при 0о С (по Кельвину при — 273о К), вода кипит при 100о С, а по Кельвину при 373о К, так как нуль Кельвина ниже нуля Цельсия на 273о. При переходе от градусов Цельсия к градусам Кельвина нужно прибавлять 273 градуса.
Фаренгейт основными точками назвал температуру, близкую к температуре застывания ртути и нормальную температуру человеческого тела. В результате температура таяния льда Фаренгейта выше примерно на 32 градуса температуры Цельсия.
Пример перехода от одной шкалы к другой:
нормальная комнатная температура
- по шкале Цельсия – 20о С;
- по шкале Кельвина – оС + 273о = 20о С + 273о = 293о К;
- по шкале Фаренгейта – о С ∙ 9/5 + 32о = 20о С ∙ 9/5 + 32о = 68о F.
Наиболее рациональной и простой в использовании считается шкала Цельсия.
(Подробно температура изучается в старших классах в разделах «Тепловые явления» и «Термодинамика»).
Молекулы в любых условиях движутся постоянно и хаотично. Движение влияет на температуру, поэтому называется оно тепловым. Тепловое движение передается и броуновским частицам. Определение этого явления: движение частиц твердого вещества, попавших в жидкость, под действием теплового движения молекул жидкости называется броуновским движением.
Итак:
- Движение молекул определяет температуру тела
- Температура измеряется термометром по шкалам Цельсия, Кельвина, Фаренгейта
- Температура – физическая характеристика тела
Из чего все состоит. Молекулы
Сейчас тела рассматривают при помощи очень мощных электронных микроскопов. Через них видно, что вещество представлено множеством мельчайших подвижных «кирпичиков». У разных веществ эти «кирпичики» различны. Их называют молекулами. А если представить, что глаза – это «глаза-микроскопы», то мысленно можно увидеть эти маленькие частички.
Молекулы, оказывается, состоят из атомов, а они еще более мелкие частицы. Например, атомы кислорода и водорода, объединившись, образуют знаменитую молекулу воды. Существует шутливая фраза: «Сапоги мои того – пропускают Н2О». Н2О – химическая формула молекулы вода. Н – обозначение водорода, О – кислорода. Индекс 2 в данному случае обозначает число атомов водорода в составе молекулы воды. Молекулы газов водорода и кислорода уже новые. В них по два атома водорода и кислорода (Н2 и О2).
Существуют вещества, состоящие только из атомов. Это металлы и инертные газы (например, неон в рекламной иллюминации). Различные комбинации атомов порождают новые вещества, существующие в природе.
Люди очень давно предполагали, что вещества составлены из молекул и атомов. Еще в пятом веке до нашей эры ученый Древней Греции Демокрит высказал такую гипотезу. В России учение о молекулярном строении вещества развил М.В. Ломоносов в восемнадцатом веке.
Как же оценить размеры загадочных маленьких частиц?
Следуя правилу измерения, их нужно с чем-то сравнить. Интересен такой мысленный эксперимент: семиклассник и молекула. Если молекулу увеличить в несколько раз так, чтобы она стала размером с семиклассника, но и его увеличить во столько же раз, то семиклассник может достать до Солнца. Наука, конечно, не пользуется такими сравнениями. Современные приборы — микроскопы позволяют найти размеры атомов и молекул довольно точно. Существует возможность подсчитать и количество маленьких частиц в любом теле.
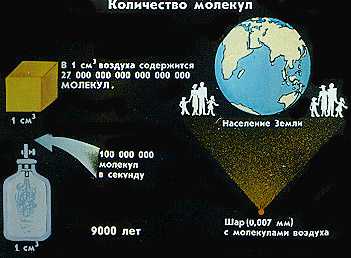
Легко догадаться, что число молекул вещества огромно. И опять интересное сравнение: если бы людей на планете Земля было столько, сколько молекул в одном кубическом сантиметре воздуха, то на одном квадратном километре Земли могли бы уместиться пять тысяч человек.
Итак, вещество состоит из молекул, а молекулы из атомов;
- разные вещества по структуре имеют разные молекулы (комбинации атомов);
- молекулы микроскопически малы, а в теле их огромное количество.
Атомистическая гипотеза
Еще в Древней Греции философами Левкиппом и Демокритом было введено понятие атомов – неких фундаментальных мельчайших блоков, слагающих материю. В эпоху паровых двигателей и становления термодинамики к этой концепции вернулись. Дальтон, Ломоносов, Лавуазье и прочие великие умы внесли вклад в формирование атомистической гипотезы, которая, тем не менее, так и не объяснила, какова структура вещества.
Считалось, что атомы – это некие неделимые частицы (корпускулы), находящиеся в постоянном движении, и из них слагалась вся материя. Такой подход позволил решить назревшие проблемы и создать новые технологии, но не более.
Основные понятия
Связи — это взаимодействия между атомами, определяющие химические реакции и структуры химических веществ. Связи позволяют атомам образовывать молекулы и другие химические соединения.
Группы элементов — это вертикальные столбцы в таблице Менделеева, которые объединяют элементы схожими химическими свойствами. Каждая группа имеет общую конфигурацию внешней оболочки электронов.
Атомы — это основные строительные блоки вещества. Атомы состоят из протонов, нейтронов и электронов. Различные атомы химических элементов имеют разное количество протонов и электронов.
Органические структуры — это структуры химических соединений, включающие углеродные атомы. Органические соединения образуются из молекул, содержащих атомы углерода.
Кристаллические структуры — это особая упорядоченная структура молекул в твердых веществах. Кристаллические структуры обладают регулярной решеткой, которая повторяется в пространстве, образуя кристаллы.
Молекула
Молекула — это наименьшая единица вещества, обладающая химической активностью и способностью сохранять свою структуру и свойства. Она состоит из атомов, объединенных связями.
Связи между атомами в молекуле определяют ее форму и свойства. Существуют различные типы связей, например, ковалентные, ионные или металлические.
В молекуле могут присутствовать различные группы, такие как функциональные группы в органических соединениях или координационные группы в комплексных соединениях.
Молекулы могут образовать кристаллические структуры, при которых атомы или группы атомов упорядочены в пространстве. Кристаллические структуры молекул определяют их физические свойства, такие как температура плавления или твердость.
Молекулы могут быть органическими или неорганическими. Органические молекулы содержат атомы углерода и образуют основу органической химии. Неорганические молекулы могут содержать другие элементы, такие как металлы или галогены.
Примеры молекул:
- Молекула воды (H2O) — состоит из двух атомов водорода и одного атома кислорода, связанных ковалентными связями.
- Молекула глюкозы (C6H12O6) — содержит шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода, объединенных ковалентными связями.
- Молекула хлора (Cl2) — состоит из двух атомов хлора, связанных одиночной ковалентной связью.
- Молекула аммиака (NH3) — содержит один атом азота и три атома водорода, связанных ковалентными связями.
Молекулы играют важную роль в химических реакциях и обладают уникальными свойствами, определяющими их функциональность и применимость в различных областях науки и технологии.
Атом
Атом — это наименьшая частица любого химического элемента, обладающая его характеристиками и не способная дальше делиться или разложиться на более мелкие частицы. Атомы собираются вместе, чтобы образовывать молекулы, которые в свою очередь составляют различные химические вещества.
В природе существуют различные виды атомов. Химические элементы — это разновидности атомов, которые имеют различное количество протонов, нейтронов и электронов. Некоторые элементы, такие как кислород и углерод, являются ключевыми для образования органических веществ, в то время как другие, такие как железо и натрий, играют важную роль в жизни организмов.
Внутри атома присутствуют податомные частицы, такие как протоны, нейтроны и электроны. Протоны имеют положительный заряд, нейтроны являются нейтральными по заряду частицами, а электроны обладают отрицательным зарядом. Протоны и нейтроны находятся в атомном ядре, а электроны находятся на орбиталях вокруг ядра.
Между атомами существуют связи, которые могут быть различными по силе и типу. В зависимости от количества электронов внешней оболочки атом может образовывать различные связи. Некоторые из них включают ионные связи, когда атомы обмениваются электронами, и ковалентные связи, когда атомы делят электроны друг с другом.
Атомы могут сгруппироваться в особые структуры, такие как кристаллические решетки, которые представляют собой периодическое повторение атомов в трехмерном пространстве. Кристаллические вещества обладают регулярной структурой и имеют четко определенные свойства, которые определяются формой и размером решетки.
Таким образом, атомы являются основными строительными блоками молекул и различных химических веществ. Они объединяются вместе, чтобы создавать разнообразие материалов, соединений и соединений, которые составляют фундамент всей химии и обеспечивают многообразие живых организмов.






























