Экологический аспект
С точки зрения чистоты для природы нет лучшего источника топлива, чем природный газ. Экологические организации полностью одобряют его использование. Однако в последние годы сгорание природного газа приводит к накоплению одного из продуктов реакции — диоксида углерода.
А так как он относится к парниковым газам, то для планеты его скопления очень опасны. Поэтому ведутся множественные работы, разрабатываются проекты по защите экологического состояния планеты от надвигающегося парникового эффекта.
-
Потенциальная энергия это кратко
-
Моральная ответственность и врачебная ошибка кратко
-
Лирический герой стихотворения весенняя гроза тютчев кратко
-
Сущность управленческих решений в менеджменте кратко
- Комиксы история возникновения кратко
Краткая история открытия газов
Современное название газам дал Жан Баптист ван Гельмонт (1580-1644), голландский химик. В первые годы XVII века он экспериментальным путем впервые получил «мертвый воздух» (углекислый газ). С этого и началось изучение газообразных соединений. Слово «газ» Гельмонт выбрал для названия по аналогии с греческим словом «хаос», так как, по его словам, видел в полученном им «паре» сходство с «хаосом древних». Но некоторые ученые спорят, что принятое сейчас обозначение все же пошло от немецкого «gasen», что в переводе означает «кипеть».Больше всего открытий ученые совершили позже, уже в XVIII-XIX веках. В 1802 г. французский исследователь Гей-Люссак открыл закон теплового расширения газов: при повышении температуры увеличивается объем газообразных веществ. Вдохновленный его примером, в 1811 итальянский химик Амедео Авогадро открыл закон, который позднее назвали его же именем. Закон звучит так: «число молекул всегда одно и то же в одинаковых объемах любых газов». Иными словами, в 1 моле любого газообразного вещества при одинаковых условиях (давление, температура) одно и то же число частиц. Это число – число Авогадро: 6,02 * 1023.Помимо выделения общих законов, в тот же период ученые постепенно открывали отдельные газы:
- 1766 – Генри Кавендиш открыл водород («гремучий газ»);
- 1772 – Генри Кавендиш получил азот;
- 1774 – Джозеф Пристли в лабораторных условиях получил кислород;
- 1776 – Ж. Лассон впервые наблюдал образование угарного газа;
- 1886 – Анри Муссан выделил фтор;
- 1785 – М. Ван-Марум обнаружил озон и так далее.
На июль 2017 года открыто 826 газов, а в будущем, возможно, к газообразному агрегатному состоянию припишут еще 90 веществ. Многие открытые газы не природные, они получены в лабораторных условиях.
Давление газа
Можно было предположить, что из-за того, что сферы или частицы газа так рассеяны и разделены, они неспособны создавать какое-либо давление на тела или объекты. Однако атмосфера доказывает, что такое мнение ошибочно: она имеет массу, вес и не дает жидкостям испаряться или закипать из ниоткуда. Температуры кипения измеряются при атмосферном давлении.
Давление газа становится более поддающимся количественной оценке, если доступны манометры или если они заключены в емкости с недеформируемыми стенками. Таким образом, чем больше частиц газа находится внутри контейнера, тем больше количество столкновений между ними и стенками контейнера.
Эти частицы, когда они сталкиваются со стенками, давят на них, поскольку они оказывают на их поверхность силу, пропорциональную их кинетической энергии. Это как если бы идеальные бильярдные шары были брошены в стену; если их будет много, они могут даже сломаться.
Метан в составе природного газа
Газ метан является основным сырьевым компонентом в составе природной смеси. Его содержание колеблется в пределах 70-98%. Сам по себе это третий по распространенности на планете газ, который входит в состав нефти, межзвездного пространства, атмосферы других планет.
С точки зрения химии, газ метан — предельный углеводород, относящийся к ряду насыщенных алифатических соединений. Самый первый представитель алканов или парафинов. Химическая активность его невелика, он достаточно спокоен. Способен вступать в реакции:
- замещения;
- полного окисления;
- конверсии.
Горит бесцветным некоптящим пламенем, запаха не имеет.
Форма газов

Газы, в отличие от жидкостей и твердых тел, не относятся к конденсированному типу; то есть агрегации или сцепления его частиц никогда не удается определить форму. Их разделяет с жидкостями то, что они полностью занимают объем емкости, в которой они находятся; однако им не хватает поверхности и поверхностного натяжения.
Если концентрация газа высока, его «язычки» или уже описанные макроскопические формы можно увидеть невооруженным глазом. Они рано или поздно исчезнут из-за действия ветра или простого расширения газа. Таким образом, газы покрывают все углы ограниченного пространства, образуя очень однородные системы.
Теперь теория удобно рассматривает газы как сферы, которые почти не сталкиваются сами с собой; но когда они это делают, они упруго подпрыгивают.
Эти сферы широко разделены друг от друга, поэтому газы практически «полны» вакуума; отсюда его универсальность, позволяющая проходить через малейшие щели или трещины, и легкость их значительного сжатия.
Поэтому, какой бы закрытой ни была пекарня, гуляя по соседству, вы обязательно насладитесь ароматом свежеиспеченного хлеба.
Физические и химические свойства инертных газов
Что стоит знать о физических и химических свойствах инертных газов? Несомненно, эти вещества являются одними из самых ценных и интригующих элементов, известных человеку. Как следует из названия, инертные газы имеют летучее агрегатное состояние и легче воздуха. Какие общие особенности имеют инертные газы? Это элементы:
- без запаха и цвета;
- легкие;
- которые очень сложно сжижаются (температура сжижения гелия составляет -268,93 °С);
- которые поддаются кипячению и плавлению при низких температурах.
Растворяются ли инертные газы в воде? Эти элементы плохо растворяются в водной среде.
Особого внимания заслуживает вопрос о реакционной способности инертных газов. Инертные газы активны или химически неактивны? Интересно, что они не вступают в химическую реакцию с другими элементами (поэтому они химически неактивны). Чем тяжелее газ, тем больше увеличивается его способность вступать в реакцию с другими молекулами. Почему инертные газы по сути химически неактивны? Это связано с тем, что они имеют набор спаренных электронов в своей валентной оболочке, что автоматически делает невозможным создание новых пар. Наличие полных электронных оболочек также объясняет то, почему инертные газы не обладают электроотрицательностью. Ведь они стабильны и не притягивают внешние электроны.

Инертные газы и их электронная конфигурация
Электронная конфигурация — это обозначение строения атомов различных элементов и расположения электронов на их оболочках. Каково строение инертных газов? У них очень упрощенная схема электронной конфигурации — самое простое обозначение касается гелия и это: 1s2 (буква s обозначает подоболочку атома). Ксенон (4d10 5s2 5p6) или аргон (1s22s22p63s23p6) и другие инертные газы, состоящие из нескольких оболочек и различного количества электронов, имеют более сложную структуру.
Плотность инертных газов
Когда мы говорим о свойствах газов, нельзя обойти вниманием вопрос об их плотности. Гелий — инертный газ с наименьшей плотностью, составляющей 0,1785 кг/м³, что делает его примерно в 7 раз легче воздуха! Для сравнения: плотность аргона составляет 1,635 кг/м³, плотность неона — 0,824 кг/м³, криптона — 3430 кг/м³, ксенона — 5396 кг/м³, а радона — 9078 кг/м³
Указанные различия в плотности достаточно велики, что сказывается, среди прочего, и на разнообразии применения инертных газов.
Цвета инертных газов — как светятся инертные газы?
В Интернете часто можно встретить вопросы типа: каким цветом светятся инертные газы? Однако следует знать, что инертные газы сами по себе не излучают никакого цвета. Ведь они бесцветные! Оттенок газа появляется под действием электрических импульсов. Гелий светится ярко-желтым светом, неон — оранжевым или красным, а аргон — синим. Под действием тока криптон приобретает зеленый цвет, а ксенон — синий, белый или фиолетовый.
Являются ли инертные газы горючими и могут ли они проводить электрический ток?
Одним из ключевых химических свойств инертных газов является их негорючесть и отсутствие явления электропроводности. Таким образом, эти летучие вещества полностью безопасны даже на предприятиях, где существует высокий риск воспламенения и возгорания. Они прекрасно проводят тепловую энергию, светятся, но не горят, поэтому нашли самое разнообразное применение в быту.
Природные месторождения газа
Если говорить о содержании природного газа в природе, то можно выделить основные места концентрации:
Если же обозначать распространение месторождений газа территориально, то лидерами являются следующие страны:
- Россия.
- Страны Персидского залива.
- США.
- Канада.
- Иран.
- Казахстан.
- Азербайджан.
- Узбекистан.
- Норвегия.
- Туркмения.
- Нидерланды.
Добыча в мире составляет ежегодно примерно 3643 млрд м 3 в год. Из них только на Россию приходится 673,46 млрд м 3 .
Температура природного газа, при которой он сгорает, равна 650 0 С. То есть это тот показатель, при котором он способен самовоспламеняться. При этом выделяется большее количество тепловой энергии, чем при горении любого другого вида топлива. Естественно, это не могло не отразиться на областях использования данного вещества.
Именно поэтому многие страны, не имеющие природных запасов газа, вынуждены импортировать его из других государств. Транспортировка осуществляется несколькими способами:
- по трубопроводу в газообразном состоянии;
- в цистернах по морскому пути — в жидком виде;
- в железнодорожных вагонах-цистернах — сжиженный.
Каждый из путей имеет свои преимущества и недостатки. В частности, морской и железнодорожный варианты более безопасные, так как химическая активность сжиженного газа в охлажденных баллонах гораздо ниже, чем в газообразном состоянии. По трубопроводу же увеличивается дальность передачи и ее объемы, кроме того, данный способ экономически выгоден.
Что такое инертные газы? Самая важная информация
Что такое инертные газы? Это так называемые гелиевые, или инертные, газы (название происходит от элемента — гелий), т. е. летучие вещества с низкой молекулярной массой. При взгляде на модели атомов инертных газов из учебников можно быстро заметить, что они имеют очень простую одноатомную структуру, не образуют более крупных кластеров и молекул.
Инертные газы отличаются прежде всего своей легкостью и почти нулевой реакционной способностью. Эти элементы существуют в свободном состоянии во Вселенной. На Земле их относительно немного, чаще всего они создаются в лабораторных условиях и на специализированных производственных предприятиях. Как можно получить инертный газ? Для этого работники лабораторий используют метод перегонки сжиженного воздуха.
Какие инертные газы были открыты за последние 200 лет? Список весьма короткий
В поисковике найдите Периодическую таблицу элементов и обратите внимание на последний, восемнадцатый, столбец. В состав группы входят 6 элементов:
- гелий (He);
- неон (Ne);
- аргон (Ar);
- криптон (Kr);
- ксенон (Хе);
- радон (Рн).
Перечисленные элементы могут совместно образовывать различные химические соединения, оксиды и кислородные кислоты.
Природный газ: состав
Если характеризовать качественный состав природного газа, то сразу нужно выделить компоненты двух групп: органические и неорганические. Поскольку хоть и принято считать, что он состоит из метана, однако это не совсем так.
К органическим составляющим относятся:
- метан — СН4;
- пропан — С3Н8;
- бутан — С4Н10;
- этан — С2Н4;
- более тяжелые углеводороды с количеством атомов углерода больше пяти.
Неорганические компоненты включают в себя следующие соединения:
- водород (в небольших количествах) — Н2;
- углекислый газ — СО2;
- гелий — Не;
- азот — N2;
- сероводород — H2S.
Каким именно будет состав той или иной смеси, зависит от источника, то есть месторождения. Этими же причинами объясняются и различные физико-химические свойства природного газа. Однако добывается любой из них, и ценность также имеет каждый. Просто какой-то вид применяется как топливо, а насыщенный посторонними примесями слишком жирно используется в химической отрасли для синтезов соединений.
Растворимость газа
Растворимость в нефти
Растворимость газа в нефти зависит от давления, температуры и состава нефти и газа. С ростом давления растворимость газа также возрастает. С ростом температуры растворимость газа снижается. Низкомолекулярные газы труднее растворяются в нефтях, чем более жирные.
С повышением плотности нефти, т.е. по мере роста в ней содержания высокомолекулярных соединений растворимость газа в ней снижается.
Показателем растворимости газа в нефти является газовый фактор – Г, показывающий количество газа в 1 м3 (или 1 т) дегазированной нефти. Он измеряется в м3/м3 или м3 /т.
По этому показателю залежи делятся на:
1) нефтяные – Г<650 м3/м3;
2) нефтяные с газовой шапкой – Г- 650 – 900 м3/м3;
3) газоконденсатные – Г>900 м3/м3.
Растворимость воды в сжатом газе
Вода растворяется в сжатом газе при высоком давлении. Это давление обусловливает возможность перемещения воды в недрах не только в жидкой, но и в газовой фазе, что обеспечивает ее большую подвижность и проницаемость через горные породы. С ростом минерализации воды растворимость ее в газе уменьшается.
Растворимость жидких углеводородов в сжатых газах
Жидкие углеводороды хорошо растворяются в сжатых газах, создавая газоконденсатные смеси. Это создает возможность переноса (миграции) жидких углеводородов в газовой фазе, обеспечивая более легкий и быстрый процесс ее перемещения сквозь толщу горных пород.
С ростом давления и температуры растворимость жидких углеводородов в газе растет.
Примеры газов
В списке газов свыше 800 наименований. Стоит рассмотреть самые распространенные:
- Кислород. Формула – O Простой газ, который состоит из двух атомов кислорода. Отличительные особенности – отсутствие запаха, цвета и вкуса. По тяжести кислород немного превосходит воздух. Газ плохо растворяется в спирте и воде, из-за чего в жидкостях часто встречаются пузырьки кислорода. Диффузия хорошо проявляется в жидком серебре. Кислород – один из самых распространенных газов. В коре нашей планеты его 47%, в атмосфере – 20%, а в мировых водах 85%.
- Водород, обозначение – H Самый легкий из встречающихся в природе газ. Его масса меньше воздуха в 14 раз. Так же, как и кислород, бесцветен и безвкусен, полностью прозрачен. В воде растворение происходит плохо, но тот же процесс успешно протекает в палладии. Водород редко встречается в качестве отдельного элемента, большой процент частиц входит в различные соединения.
- Углекислый газ, CO Относится к сложным органическим газам. Объем в атмосфере – менее 1%. Способен кристаллизоваться при температуре -78,3 градуса по Цельсию, переходить в жидкое состояние при температуре 18-25 и давлении 6 Мпа. Тяжелее воздуха, но разница не такая значительная, как у водорода: масса больше в 1,5 раза. В обычных концентрациях у углекислого газа нет запаха и вкуса, но при больших скоплениях появляется кислый аромат (отсюда и название).
- Азот, N Занимает 78% атмосферы, но встречается и за пределами нашей планеты. В отличие от других газов, у азота прочная тройная связь, которую сложно разорвать. Азот растворяется в воде в 2 раза хуже, чем кислород, и в 8 раз хуже, чем водород. Вещество не имеет запаха.
Сравнение химических свойств газов
| Газы | Химические свойства |
|---|---|
| Аргон (Ar) | Не реагирует с другими элементами, не является питательным для живых организмов. |
| Азот (N2) | Не реагирует с металлами, не горит, не поддерживает горение. В природе азот встречается в свободном состоянии в атмосфере, а также является составной частью многих органических соединений. |
| Водород (H2) | Горит в кислороде, образует соединения с неметаллами. В природе водород встречается в свободном виде в атмосфере, а также в составе воды и многих органических соединений. |
| Гелий (He) | Не реагирует с другими элементами, не является питательным для живых организмов. |
| Диоксид углерода (CO2) | Не горит, образует кислоты с водой. Углекислый газ является одним из главных газов, участвующих в процессах фотосинтеза. Он также образуется в результате сгорания углеводородов. |
| Кислород (O2) | Окисляет металлы, образует соединения с водородом. В природе кислород встречается в свободном виде в атмосфере, а также в составе многих минералов и органических соединений. |
| Метан (CH4) | Горит в кислороде, образует воду и углекислый газ. Метан является одним из главных компонентов природного газа, а также образуется в результате биологических процессов в животных и растениях. |
| Неон (Ne) | Не реагирует с другими элементами, не является питательным для живых организмов. |
| Фтор (F2) | Ядовитый газ, образует соединения с металлами, галогенами и кислородом. В природе встречается в виде фторида кальция и других минералов. |
| Хлор (Cl2) | Окисляет и разрушает органические вещества, образует кислоты с водой. Хлор является химическим элементом, который в природе встречается в виде хлорида натрия и других соединений в морской воде и в земной коре. |
В таблице приведены основные газы и их химические свойства. Каждый газ имеет свои уникальные химические свойства, которые определяют его способность взаимодействовать с другими элементами и участвовать в различных химических процессах. Они находят широкое применение в различных областях, от медицины до промышленности.
Все перечисленные газы входят в состав воздуха и образуют земную атмосферу. Но большая часть, 98-99%, приходится на азот и кислород.Если имеется желание, познакомиться с газообразными веществами поближе всегда можно при помощи лабораторных экспериментов
Однако при работе с газами нужно соблюдать предельную осторожность
Виды природного газа
Существует три основных вида рассматриваемого вещества.
- Сухой природный газ — это такой, в котором метана более 97%. То есть содержание примесей, в том числе других углеводородов, крайне низкое.
- Тощий газ. Так называют смесь, содержащую незначительное количество тяжелых углеводородов.
- Жирный природный газ — тот, что богат на тяжелые углеводороды и неорганические компоненты (азот, водород, гелий, аргон, углекислый газ, сероводород).
Такое понятие, как коэффициент сухости газа, позволяет оценить качество сырья, из которого в дальнейшем будет изготовляться продукция. Ведь сам природный газ — это лишь база. Для разных отраслей промышленности нужен свой продукт, поэтому он проходит тщательную обработку и очистку в соответствии с конкретными требованиями.
Применение инертных газов: аргона, гелия и неона
Гелий, аргон и неон — элементы, привлекающие ученых и инвесторов с девятнадцатого века. Человечество постоянно ищет ответы на вопросы о возможном применении инертных газов, которые человек начал массово использовать только в двадцатом веке. Вы имеете дело с элементами Хе, Ар и Ne каждый день. Они входят в состав множества различных предметов, которые вы используете, — вот краткий обзор того, для чего нужны инертные газы:
Гелий
У вас он наверняка ассоциируется с баловством, плавающими в воздухе шариками для детей — и правильно, он продается как газ для наполнения шариков. Именно он заставляет разноцветные воздушные шарики улетать высоко вверх. Этот элемент также используют в следующих областях:
- производство дыхательных смесей для профессиональных водолазов;
- добыча природного газа;
- холодильные установки;
- сварочные процессы;
- приведение в действие дирижаблей, личных воздушных шаров.
Гелий как самый легкий газ нашел применение и в лабораториях как носитель различных веществ. В промышленности этот элемент также используют для диагностики протекания в установках, резервуарах и т. д.
Неон
Когда вы слышите слово «неон», вы можете представить себе светящуюся вывеску магазина или яркую городскую рекламу. И неудивительно, ведь неон — это не только название элемента, это еще и электрическая люминесцентная лампа (рекламная или декоративная), состоящая из цветных трубок, известная с начала двадцатого века. Что стоит знать о применении неона? В настоящее время его в основном используют, чтобы производить:
- средства освещения (светильники, лампочки);
- фотодиоды;
- лазеры;
- компоненты телевизоров.
Аргон
Газ аргон был открыт в конце девятнадцатого века. В настоящее время его применяют, среди прочего, для производства лампочек, энергосберегающих окон и полупроводников. Аргон позволяет создавать защитную атмосферу в различных технологических процессах, таких как упаковка или сварка. Он также бесценен в лабораториях и хроматографии, полезен в процессах разделения различных веществ.

§ 37. Аммиак
Водородное соединение азота аммиак — вещество молекулярного строения. Его структурная формула . В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподелённая пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
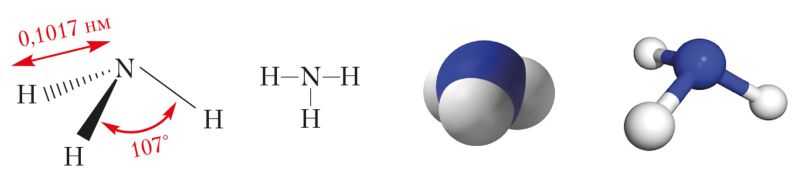 Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Рис. 89. Пространственная и структурная формулы, масштабная и шаростержневая модели молекулы аммиака
Взаимное отталкивание атомов водорода приводит к увеличению валентного угла между направлениями ковалентных связей N—H от 90° до 107°.
Строение молекулы аммиака. Форма пирамиды в молекуле аммиака и валентный угол 107° при её вершине объясняются образованием связей между гибридными орбиталями атома азота и s-орбиталями атома водорода.
Согласно концепции гибридизации, в образовании ковалентных связей участвуют не исходные валентные три 2p-орбитали внешнего электронного уровня атома азота, а три из четырёх sp3-гибридных орбиталей, схема образования которых показана на рисунке 89.1(а–г).
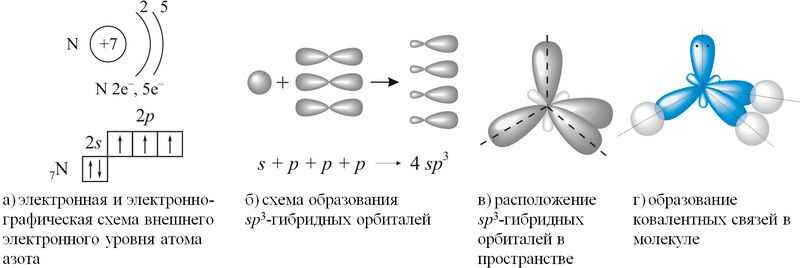 Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Рис. 89.1. Схема образования ковалентных связей в молекуле аммиака
Неподелённая электронная пара четвёртой гибридной орбитали обладает незначительной отталкивающей силой, что объясняет уменьшение валентного угла H—N—H со 109,5° до 107. Расположение трёх ковалентных полярных связей под углом приводит к асимметричному распределению электронной плотности, то есть к полярности молекулы:

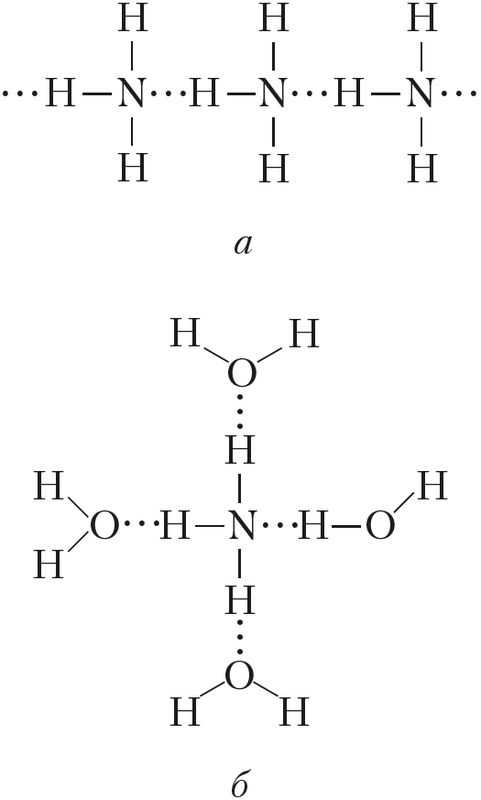 Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Рис. 90. Водородные связи: а — в жидком аммиаке, б — в водном растворе аммиака
Физические свойства. Аммиак — бесцветный газ (н. у.) с характерным резким запахом (запах нашатырного спирта). Он хорошо растворяется в воде: при 20 °С в одном объёме воды растворяется около 700 объёмов аммиака (сравним: О2 — 0,03, SO2 — 40, НСl — 400 объёмов). Температура кипения аммиака довольно высокая и составляет –33 °С. При небольшом давлении этот газ легко сжижается. Температура плавления — –78 °С, ниже её аммиак существует в виде бесцветных кристаллов. Высокая температура кипения и растворимость в воде обусловлены наличием значительного межмолекулярного взаимодействия, то есть образованием водородных связей как между самими молекулами аммиака (в твёрдом и жидком состояниях), так и между молекулами воды и аммиака (в водном растворе) (рис. 90).
Получение аммиака. Аммиак является одним из ключевых продуктов химической промышленности. Его мировое производство растёт вместе с глобальным спросом на удобрения и в настоящее время превышает 220 млн тонн в год. В Республике Беларусь его производит ОАО «Гродно Азот» — более 1 млн тонн в год.
В промышленности аммиак синтезируют из азота и водорода. Реакция экзотермическая и обратимая, катализатором служит железо, оптимальная температура синтеза — 420–450°С, давление — 30–100 МПа:
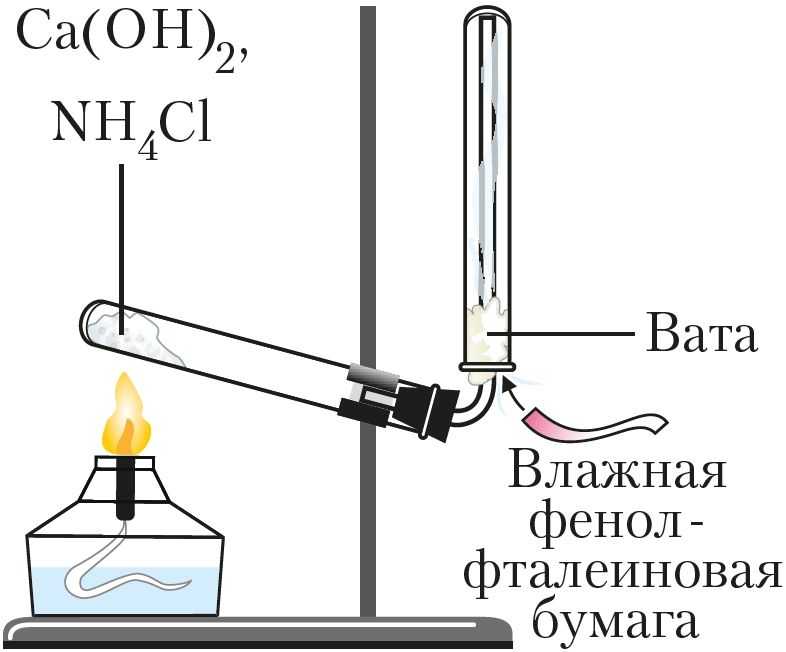 Рис. 91. Получение аммиака в лаборатории
Рис. 91. Получение аммиака в лаборатории
Для получения аммиака в лаборатории нагревают смесь двух твёрдых веществ — хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 (рис. 91):
Химические свойства. Для аммиака характерны реакции, протекающие как без изменения степени окисления азота, так и окислительно-восстановительные. В первом случае основную роль играет неподелённая электронная пара атома азота. За счёт её образуются новые ковалентные связи по донорно-акцепторному механизму. С другой стороны, наличие атома азота в низшей степени окисления ‒3 обусловливает реакции только с повышением степени окисления. Это означает, что аммиак проявляет свойства восстановителя.
I. Реакции без изменения степени окисления протекают, если аммиак взаимодействует с водой и кислотами. При этом аммиак проявляет основные свойства.
Растворение аммиака в воде приводит к образованию гидрата аммиака NH3· H2O — слабого основания (рис. 92).
 Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Рис. 92. Растворение аммиака в воде: а — через капилляр — «фонтан», б — в пробирке
Водные растворы аммиака имеют щелочную среду (рН > 7) и окрашиваются фенолфталеином в малиновый цвет.
Взаимодействие аммиака с кислотами:
II. Реакции с изменением степени окисления атома азота. Это реакции аммиака как восстановителя. Восстановительные свойства аммиак проявляет в реакциях с кислородом. Состав продуктов зависит от условий проведения реакции. В чистом кислороде и на воздухе он сгорает при нагревании (в смесях — взрывается) с образованием азота и воды, а в присутствии катализаторов (платины, оксидов железа(III) и хрома(III)) образуются оксид азота(II) и вода:
Реакция каталитического окисления аммиака важна как этап его переработки в азотную кислоту.





























