Строение атома
Атом (от греческого atomos — неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается. Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A—Z).
Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), называется нуклидом (это могут быть как разные элементы с одинаковым общим количеством нуклонов (изобары) или нейтронов (изотоны), так и один химический элемент — одно количество протонов, но разное количество нейтронов (изомеры)).
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10-19 | 1 | 1,7·10×10-24 |
| нейтрон | 1 | 1,7·10×10-24 | ||
| электрон | -1 | -1,6·10×10-19 | 9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.
Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь
Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства
Физика относится к науке полной тайн и загадок, а одной из увлекательных страниц ее истории, несомненно, является открытие строения сложного атома. Так к концу XIX века в обществе витало много предположений, что строение атома не так уж и просто. Все это стало известно благодаря открытию электролиза и самого электрона. Теории о существовании атома, как неделимой частицы, которая нас окружает, уходит своими корнями еще в далекое прошлое. Само понятие атом существовало еще и до н.э. Ученый Демокрит был убежденным исследователем атома. Он представлял себе картину мира следующим образом.
Все тела состоят из атомов, у которых неделимая и неизменная форма, число этих атомов неограниченно, так же как и число их типов, они смело могут образовывать различные соединения, благодаря различным крючкам и выступам, ну и ко всему они находятся в постоянном движении. В России огромное значение в исследовании атомной теории внес Ломоносов, разделяя две части материи – элементы и корпускулы. Основываясь на этих данных, ученые физики продолжали философствовать о строении атома, и, вскоре, после открытия электрона в 1897 году, Дж. Дж. Томсоном была представлена модель атомного строение.
Вскоре была доказана несостоятельность этой теории. Модель строения атома Томсона противоречила опытам, которые были проведены Резерфордом. Резерфорд – это выдающийся ученый, основатель некоторых направлений в физики, лауреат Нобелевской премии. В начале 19 столетия, благодаря своим исследованиям, он доказал то, что атом имеет ядро. Оно заряжено положительно и занимает небольшую часть у атома, вокруг самого ядра двигаются электроны. Эти данные были опубликованы в Лондонском журнале по философии 1911 года.
Большой шаг в исследовании строения атома сделал Н. Бор. Им был сделан анализ всех данные, что привело его к выводу – описание систем атомов не должно ограничиваться привычными представлениями в физики. Им были написаны постулаты – о стационарных состояниях и правило частот. Его теория оказала огромный клад в развитие физики, химии, выяснении структуры атома, спектроскопии и т.д. Но оставались вещи, которые она и не могла объяснить. Так Бор представлял, что движение электронов просто механическое, хотя оно не являлось таковым. В дальнейшем это было объяснено с помощью новой теории кванта.
Открытие урана в 1939 году доподлинно подтвердило, что атом способен делится. Ко всему он состоит не только из мелких частиц. Эти части способны к самопроизвольному испусканию при радиоактивном разрушении. Атом еще и способен давать излучение, и которое может быть не только видимое, но также и электромагнитное (пример: х-лучи).
-
Позитивизм в истории методологической мысли кратко
-
Встреча на которой кратко излагается позиция по одному из злободневных вопросов
-
Укрепление государственного аппарата при николае 1 кратко
-
Тихвинская оборонительная операция кратко
- Российская эмиграция в 20 веке кратко
Что такое атом?
Итак, внутри нашей молекулярной матрешки обнаружилась матрешка атомная. Возможно, вы не до конца уловили, как мистеру Далтону удалось без микроскопов, практически с завязанными глазами, показать, что молекулы ряда веществ имеют деление на элементы еще более маленького порядка. Это нормально: подноготная подобных экспериментальных заключений станет яснее далее при изучении курса химии. Как и полная история открытия современного понятия атома. Вы обязательно познакомитесь с атомом снова — полнее и фундаментальнее.
Сейчас нам достаточно разобрать матрешку до куколки, где «рождаются» электрические процессы.
Поэтому чтобы не запутать и без того запутанную тему, опустим детали, как Томпсон открывает электрон экспериментами с вакуумной трубкой, как к делу подключаются Резерфорд, Бор, Планк, Содди, Гейзенберг, внося лепту в понимание подлинного строения вещества — это все впереди. Просто чтобы вы осознавали: ученые на протяжении десятилетий взаимодополняли опыты друг друга, постепенно открывая все новые и новые положения. Атом — коллективная находка, и к ней шли очень долго.
Так что остановимся исключительно на результатах.
Опыт Резерфорда по рассеянию альфа-частиц
Начало XX века. Минувшее столетие было богато великими физическими открытиями — рентгеновские лучи, радиоактивность, магнитное действие электрического тока и др. Они заложили основу технического прогресса XX столетия, но не внесли полную ясность в строение атома. Хотя его сложность уже ни у кого не вызывала сомнения.
Любая гипотеза в науке нуждается в экспериментальной проверке. Английский физик Эрнст Резерфорд конструирует установку, позволившую «анатомировать» атом, т.е. узнать его внутреннее строение, а значит проверить томпсоновскую модель атома.
В его опытах радиоактивное вещество, помещенное в свинцовый контейнер, являлось источником альфа излучения. Его узкий пучок направлялся на специальный экран, вызывая на нём световые вспышки (сцинтилляции). Затем на его пути устанавливалась тончайшая золотая фольга. Рассуждения Резерфорда были следующими: если модель Томпсона верна, тяжёлые положительные альфа частицы не пройдут через равномерно рассредоточенный положительный заряд в атомах золота. Следовательно, на люминесцентном экране сцинтилляций не будет.
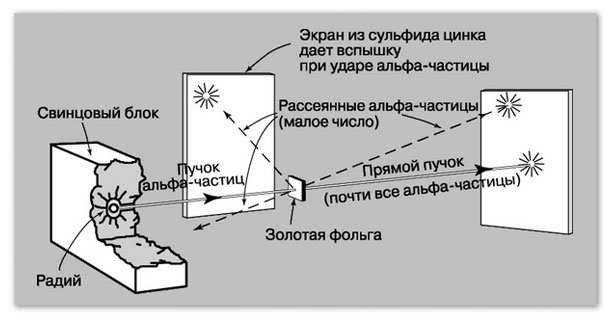
Однако огромное количество опытов, выполненных на этой установке, показали совершенно иную картину. Альфа частицы проходили через металлическую фольгу, лишь испытывая отклонение на различные углы, даже возвращаясь назад, как будто встречаясь с непреодолимым препятствием.
Результаты эксперимента учёный объяснил воздействием на альфа частицы чрезвычайно сильного электрического поля, создаваемого зарядом малых размеров, но большой массы (ядра).
Альфа частицы, пролетающие вблизи ядра, отталкиваются от него, отклоняясь на различные углы. Те из них, которые попадают на ядро, отбрасываются на 180 градусов.
Строение атома
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
Рис. 1. Электронно-графическая формула атома.
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Из чего состоит атом?
Оказывается, внутри атома также кипит жизнь, — а вот, наша атомная матрешка приоткрывает субатомную матрешку. По итогу, научный мир договорился, что внутренности атомов выглядят примерно следующим образом.
Перед вами — атом кислорода
Обратите внимание на две зоны: то, что в центре, и то, что происходит «вокруг центра».. Абсолютно каждый атом состоит из двух частей: ядра и оболочки — того, что располагается вокруг ядра
Оболочка состоит из частичек, которые мы называем электронами. Ядро представляет собой еще одну матрешку, так как оно в свою очередь тоже делится: эти составные части ядра мы стали называть нейтронами и протонами
Абсолютно каждый атом состоит из двух частей: ядра и оболочки — того, что располагается вокруг ядра. Оболочка состоит из частичек, которые мы называем электронами. Ядро представляет собой еще одну матрешку, так как оно в свою очередь тоже делится: эти составные части ядра мы стали называть нейтронами и протонами.
| Элемент атома | Что такое? |
|---|---|
| Нейтрон | Самый тяжелый элемент атома. Находится в ядре. Не имеет электрического заряда. |
| Протон | Следующая элементарная частица ядра. Является носителем положительного электрического заряда. |
| Электрон | Вращаются орбитально вокруг ядра. Является носителем наименьшего электрического заряда. |
О, электрический заряд? Электрон? Созвучно с электричеством? Да?
Кажется, мы дошли до той самой крайней матрешки, которую искали с начала урока. И матрешка эта представляет собой внутренности атомов. Там мы и обнаружим то, что нас интересует — электричество.
Открытие электрона и модель Резерфорда
В начале XX века в физике произошел ряд важных открытий, которые привели к развитию моделей атома. Одним из таких открытий было открытие электрона.
В 1897 году английский физик Джозеф Джон Томсон провел серию экспериментов с катодными лучами и установил, что в составе атомов присутствуют неподвижные отрицательно заряженные частицы – электроны. Он также определил отношение заряда электрона к его массе и получил значение электронного заряда. Открытие электрона дало толчок к разработке новых моделей атома.
Одной из таких моделей была модель атома Резерфорда, предложенная в 1911 году небританским физиком Эрнестом Резерфордом. Согласно этой модели, положительно заряженное ядро находится в центре атома и содержит практически всю массу атома, а отрицательно заряженные электроны движутся по орбитам вокруг ядра. Электроны не могут находиться на всех орбитах, а только на определенных, названных энергетическими уровнями. Это объясняло стабильность атомов и возможность образования химических связей.
Модель Резерфорда имела важное значение для понимания строения атома и электронного строения вещества. Но уже через несколько лет после его опубликования стали известны некоторые противоречия, которые не могли объясниться этой моделью
Например, согласно модели Резерфорда, электроны в атоме двигались со значительными ускорениями, что означало, что они должны были постепенно терять энергию и, в конечном итоге, упасть на ядро. Но, как известно, это не происходит в реальности.
Таким образом, модель Резерфорда позволила сделать важный шаг в исследовании атома, но она была не в состоянии полностью объяснить все наблюдаемые явления. Позже были предложены другие модели атома, которые были более точны и описывали большее количество данных.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
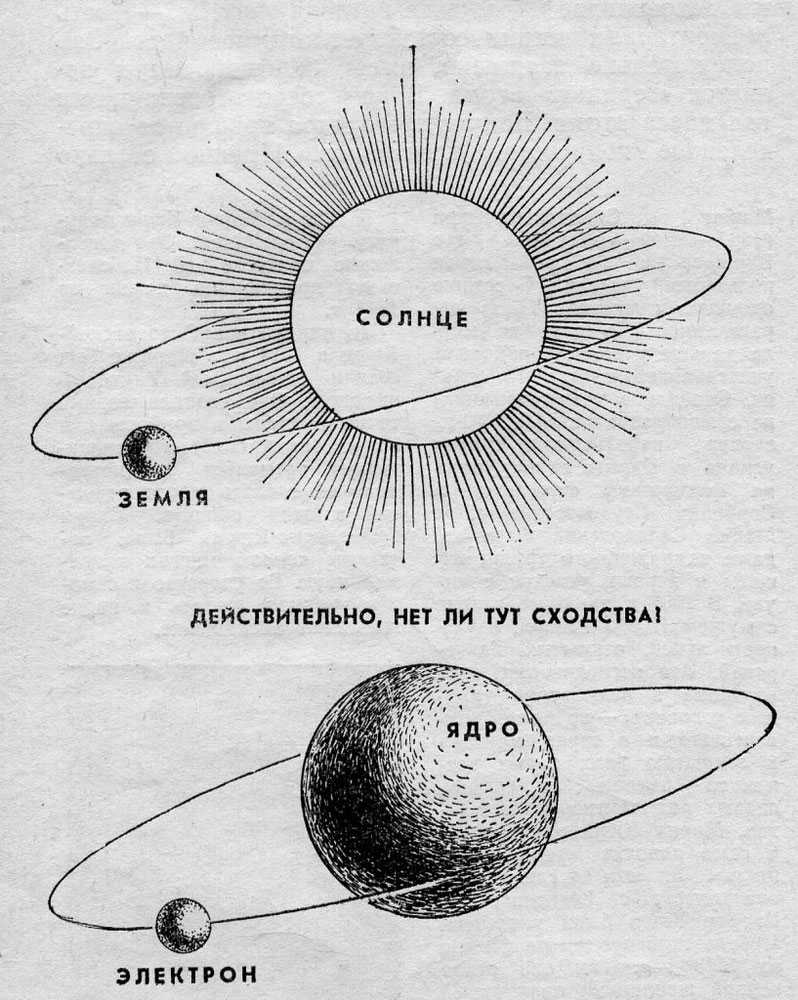 Планетарная модель
Планетарная модель
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц — кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
Схема строения атома
Эксперименты и открытия в современной науке
Современная наука продолжает активно исследовать структуру и свойства атома. С помощью различных экспериментальных методов и технологий мы можем более глубоко понять его устройство и взаимодействия.
Одним из важных открытий является открытие элементарных частиц, которые входят в состав атомного ядра. На протяжении многих лет физики исследовали различные частицы, такие как протоны, нейтроны и электроны. Было установлено, что протоны и нейтроны находятся в ядре атома, а электроны обращаются по орбитам вокруг ядра.
Еще одним важным экспериментом было открытие ядерного расщепления. В 1938 году Отто Ган и Фриц Штратман произвели эксперимент, в результате которого удалось расщепить ядро урана на два более легких ядра. Это открытие стало основой для развития атомной энергетики и создания атомной бомбы.
Современные эксперименты проводятся с использованием высокоточных приборов и акселераторов частиц. Одним из таких экспериментов было открытие Бозона Хиггса в 2012 году, которое подтвердило существование поля, дающего частицам массу. Это открытие было важным шагом в понимании фундаментальных свойств Вселенной.
Также современные ученые исследуют взаимодействие атомов и молекул с использованием лазеров и специальных методов детекции. С помощью этих экспериментов ученые могут изучать молекулярные структуры и процессы, а также разрабатывать новые материалы и технологии.
В целом, современные эксперименты и открытия позволяют нам получать все более точное представление о строении атома и его свойствах. Они дают возможность разрабатывать новые технологии и применения в различных областях, таких как медицина, энергетика и материаловедение.
Открытие химических элементов
В процессе изучения атома ученые смогли обнаружить и определить существование различных химических элементов
Открытие новых элементов было важной частью истории атомной науки
Первый химический элемент, открытый античными философами, был свинец. Они наблюдали, что этот металл имеет отличные химические и физические свойства и является неотъемлемой частью природы.
В 18-19 веках ученые проводили различные эксперименты и открыли ряд новых химических элементов. Так, Антуан Лавуазье в 1789 году определил существование элементов кислорода, водорода и азота. В 1807 году Хумфри Дэйви разработал метод электролиза и открыл элементы натрий и калий.
В конце 19 века были открыты несколько элементов благодаря развитию аналитической химии и разработке новых методов исследования. Дмитрий Менделеев, русский химик, разработал периодическую систему элементов, которая стала базой для открытия новых элементов. Он предсказал существование ряда элементов, которые были открыты позже, включая германий, галий и скафандий.
В 20 веке с использованием более современных технологий было проведено множество экспериментов, которые привели к открытию множества новых химических элементов. Открытие таких элементов, как ксенон, радон и астатин, подтвердило представление об атоме и его строении.
Сегоднясшние исследования направлены на синтез и создание искусственных элементов. Ученые стремятся расширить периодическую систему элементов и глубже понять структуру атома и его свойства.
Модель атома Томпсона или «пудинг с изюмом»
Поскольку атомы электронейтральны, то отрицательный заряд электронов должен иметь в атоме свой антипод, т. е. положительно заряженную часть. И Томпсон предлагает структуру атома, получившую название «пудинг с изюмом» или «кекс с изюмом». По его мнению, атом — это сфера, в которой равномерно распределён положительный заряд, в неё вкраплены электроны, нейтрализующие этот положительный заряд.
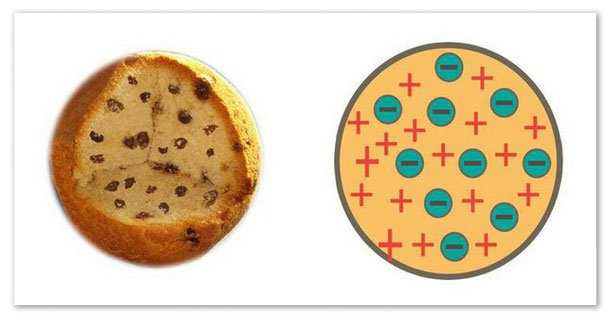
Эта модель объясняла некоторые проблемы, интересовавшие физиков, но была абсолютно беспомощна при попытке объяснения радиоактивности. В частности, в объяснении природы альфа-частиц.
Рождение науки
История изучения атома начинается с древних греков, которые впервые предположили его существование. Именно в древности были изобретены основные понятия, которые сегодня используются в атомной физике.
В V веке до н.э. Демокрит и Левкипп поставили основы атомной теории. Они предполагали, что все материальные объекты состоят из неделимых и непостижимых частиц – атомов. Эти ученые пришли к выводу, что различия между объектами объясняются их различной формой, величиной и положением атомов.
В течение долгого времени идея атома была отвергнута в пользу альтернативных теорий. Однако, в XVII и XVIII веках, с развитием науки и появлением новых экспериментальных методов, идея атома снова начала набирать силу.
|
В XVII веке Роберт Бойль сформулировал законы, описывающие поведение газов. Он установил, что при постоянной температуре и давлении, объем газа обратно пропорционален его давлению. Это подтверждало гипотезу Бойля, согласно которой молекулы газа являются отдельными частицами, передвигающимися внутри объема газовой смеси. |
|
|
В XVIII веке Жан-Батист Жозеф и Антуан Лавуазье провели исследования, связанные с законами сохранения массы при химических реакциях. Они пришли к выводу, что химические реакции протекают в результате перегруппировки атомов, а не их создания или уничтожения. Это подкрепило идею о том, что атому является фундаментальной частицей вещества. |
Кроме того, в XIX веке Джон Долтон разработал первую научную модель атома. Он предложил, что атомы – это неделимые частицы, взаимодействующие друг с другом для образования соединений. Он также сформулировал первую таблицу атомных масс, которая стала основой для развития химической теории.
Таким образом, благодаря работе ученых разных эпох, были заложены основы атомной физики и химии. Их исследования сформировали базу для дальнейшего развития науки и изучения микромира атомов.
Планетарная модель атома
Английский ученый Томсон в 1903 году предложил первую модель атома.
Положительный заряд атома занимает весь объем атома и распределен в этом атоме с постоянной плотностью, а внутри него находятся электроны.
Модель атома Томсона сравнивают с «булочкой с изюмом», в которой роль изюминок играют электроны.
Атом водорода, согласно этой модели, представляет собой положительно заряженный шар радиусом 10-8 м, внутри которого находится электрон. У более сложных атомов внутри положительно заряженного шара находятся несколько электронов.
Модель атома Томсона не получила экспериментального подтверждения.
Опыт Резерфорда по рассеянию \( \alpha \)-частиц
В начале ХХ века английский ученый Э. Резерфорд исследовал прохождение узкого пучка \( \alpha \)-частиц через золотую фольгу толщиной около 4 · 10-7 м.
Для изучения строения атома Резерфорд предложил зондирование атома с помощью \( \alpha \)-частиц, которые испускались радиоактивным элементом 1, помещенным внутри свинцового цилиндра, поглощающего все \( \alpha \)-частицы, кроме тех, которые проходили через узкий канал 2. Узкий пучок \( \alpha \)-частиц попадал на фольгу из золота 3. Рассеянные после взаимодействия с золотом \( \alpha \)-частицы регистрировались визуально с помощью светочувствительного экрана и микроскопа 4.
В результате опыта было обнаружено, что, хотя большая часть \( \alpha \)-частиц проходила сквозь тонкий слой вещества, почти не отклоняясь от первоначального направления, очень небольшая доля этих частиц отклонялась на большие углы. Это возможно только под действием большой кулоновской силы, которая является результатом лобового столкновения положительно заряженной \( \alpha \)-частицы с положительным зарядом в атоме. Размеры этого заряда очень малы. Резерфорд назвал его «ядро атома» и в 1911 году предложил планетарную модель атома.
Планетарная модель атома
Резерфорд предположил, что атом представляет собой миниатюрную планетарную систему, в которой действуют электрические силы притяжения. В центре каждого атома находится положительно заряженное ядро. Вокруг ядра по эллиптическим орбитам вращаются отрицательно заряженные электроны.
В ядре сосредоточена практически вся масса атома, но оно занимает ничтожно малую часть его объема. Электронная оболочка занимает большую часть объема атома, но ее масса мала.
В целом атом нейтрален, т. к. суммарный отрицательный заряд электронов равен положительному заряду атомного ядра.
Планетарная модель атома Резерфорда не смогла объяснить ряд важнейших свойств атомов. В частности, атом, согласно классической механике, должен излучать электромагнитные волны, т. к. электроны движутся с ускорением (центростремительным). Это должно приводить к уменьшению энергии атома, а следовательно, к падению электрона на ядро. Однако атомы обычно не излучают электромагнитные волны и устойчивы.
Как выглядит атом?
А что это там такое сверху крутится необычное?
Выше вы наблюдаете атом кислорода в процессе «жизнедеятельности». Вернее, его схематичное, примерное представление. Мы не особо-то и знаем, как на самом деле выглядит атом. Не забывайте: мы находимся на данный момент на таком миниатюрном уровне, где работают исключительно допущения, предположения, догадки и опыты на основе догадок.
Важно. Вообще, на Земле, по состоянию на 2021 год, насчитывается $118$ различных атомов, не считая изотопы — так скажем, вариации атома
Только вообразите: состав любой материи ограничен. И на то, чтобы составить все многообразие нашей планеты, требуется всего лишь $118$ частичек, называемых атомами. В разных комбинациях.
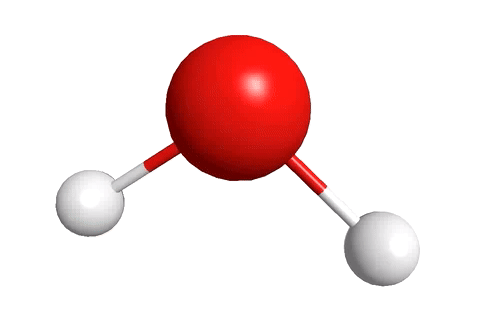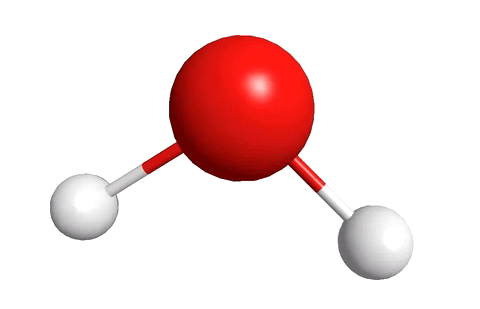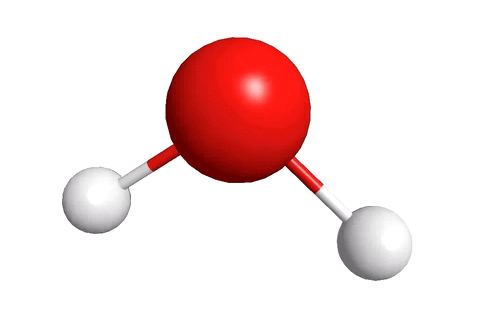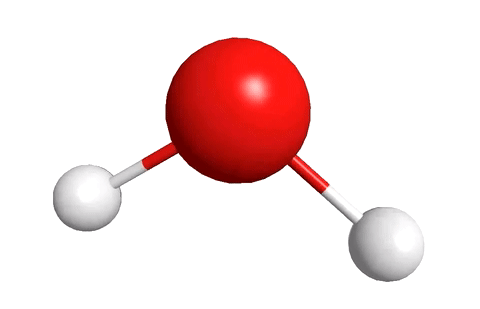
Молекула воды, к примеру, состоит из двух атомов водорода и одного атома кислорода.
Возьмите один атом хлора и один атом натрия — получите соль. Возьмите три атома кислорода — получите озон. Да, тот самый, который странно, но приятно пахнет. Возьмите два атома водорода, один атом серы и четыре атома кислорода — получите серную кислоту. Всего лишь чуть больше атомов кислорода и наличие серы может с легкостью нанести ужасные увечья кожному покрову, в отличие от воды, в которой так-то тоже есть и водород, и кислород. Однако кожу она вам не разъест.
Продолжать можно очень долго. Полный перечень ста восемнадцати атомов, куда входят и вышеупомянутый кислород, и водород, и сера, и прочее, записан в периодической таблице Менделеева — крайне вероятно, что вы про нее что-нибудь да слышали.
Вихман Э. Квантовая физика. М.: Наука, 2007.
5. Григорьев В.И., Мякишев Г.Я. Силы в природе.// М.: Наука, 2003.
6. Джеммер М. Эволюция понятий квантовой механики. М.: Наука, 2005.
7. Ельяшевич М.А. Атом; Атомная физика; Атомные спектры. Физическая энциклопедия, т. 1. М.: Наука, 2008.
8. Зоммерфельд А. Строение атома и спектры. Том 1, М.: Наука,, 2006.
9. Зоммерфельд А. Строение атома и спектры. Том 2, М.: Наука,, 2006.
10. Коровин Н.В., Курс общей химии — М: Высшая школа,2010. — 446с.
11. Кременчугская М., Васильева С., Химия — М: Слово, 2010. — 479с.
12. Кудрявцев П.С. Курс истории физики.// М., Просвещение, 2002 г.
13. Кульман А. Г., Общая химия- М: Наука, 2006. — 578с.
14. Полинг Л., Полинг П. Химия -М: Мир, 2008. — 685с.
15. Савина О. М., Энциклопедия — М.: АСТ, 2006. — 448с.
Размещено на Allbest.ru

























