Кислород и его аллотропные модификации
Кислород является химическим элементом с символом O и атомным номером 8. Он является одним из наиболее распространенных элементов на Земле и является существенным для поддержания жизни. Кислород обладает несколькими аллотропными модификациями, что значит, что он может существовать в различных физических и химических формах.
Одной из форм кислорода является молекулярный кислород (O2), который состоит из двух атомов кислорода, связанных с помощью двойной ковалентной связи. Молекулярный кислород является подавляющим компонентом в атмосфере Земли и играет ключевую роль в дыхании живых организмов.
Кроме того, существуют другие аллотропные модификации кислорода, включая одноатомный кислород (О) и тройной кислород (O3), также известный как озон. Одноатомный кислород образуется в результате фотолиза молекулярного кислорода под воздействием ультрафиолетового излучения и является очень реакционноспособным.
Озон, в свою очередь, образуется в стратосфере под воздействием ультрафиолетового излучения от Солнца. Он служит своеобразным фильтром, поглощая определенные участки ультрафиолетового излучения, которые могут быть опасны для живых организмов.
Аллотропия кислорода имеет значительное значение в различных областях химии и науки. Например, молекулярный кислород используется в различных химических реакциях и процессах, включая сжигание и дыхание. Озон служит эффективным окислителем и используется в различных промышленных и медицинских приложениях. Одноатомный кислород также применяется в различных реакциях и процессах, а также в лазерной технологии и аналитической химии.
В заключение, кислород обладает несколькими аллотропными модификациями, включая молекулярный кислород, одноатомный кислород и озон. Каждая из этих форм имеет свои уникальные свойства и применения в химии и науке. Понимание и использование аллотропии кислорода позволяет расширить наши знания о данном элементе и его использовании в различных областях жизни и технологии.
Обратимые и непоправимые переходы
В случае изменения температурных показателей и параметров давления твердые материалы переходят из одной структуры в другую без перемены количественного состава элементов. Предпосылками является подвижность частиц решетки и перенос некоторого количества вещества, вызванный дефектами строения твердого состояния.
Примеры переходов:
- энантиотропные преобразования (обратимые);
- монотропные видоизменения (необратимые).

Проводят разработанную методику трехфазной реакции для направленного получения требуемой решеточной структуры. Выбор нагревательного режима и продолжительность повышения температуры ускоряет рост кристаллов до больших зерен, что улучшает качество. Изменение способа обработки направляется иногда на снижение активности катализаторов в результате процесса рекристаллизации.
Энантиотропное видоизменение возникает при нулевой температуре и выбранном давлении. Иногда аллотропное преобразование относится к необратимым и одно из состояний материала является неустойчивым в термическом плане. Эта фаза сохраняется на всем температурном интервале от абсолютного нуля и называется монотропным. При получении серого олова из белого происходит обратимое преобразование, а превращение алмаза в графит становится необратимым.

Отличие этих типов превращений — в технологических особенностях проведения. Энантиотропные переходы модификации А чаще получаются методом постепенного охлаждения сплава. Сначала масса кристаллизуется в виде состояния Б, которое затем видоизменяется в устойчивую фазу к низким температурам.
При монотропном переходе в случае охлаждения сплава образуется только вещество в состоянии А. Требуется особый технологический режим со строгим дозированием понижения температуры и давления для получения модификации Б. Примером служит получение стабильного черного фосфора из белого путем нагревания до + 200ºС и повышения давления до 1,25 ГПа. После помещения полученного образца в нормальные условия обратного преобразования не происходит.
Оксиды металлов как аллотропные соединения
Оксиды металлов являются классом аллотропных соединений, которые образуются при реакции металла с кислородом. Аллотропия — это свойство некоторых элементов образовывать разные физические формы с одинаковым химическим составом. Это значит, что оксиды металлов могут существовать в различных структурных модификациях.
Одним из примеров аллотропии оксидов является оксид железа, который может существовать в трех разных формах: FeO, Fe2O3 и Fe3O4. Каждая из этих форм имеет свою уникальную структуру и свойства. Например, FeO обладает магнитными свойствами, Fe2O3 является химически активным оксидом, а Fe3O4 является полупроводником.
Оксиды металлов широко используются в химической промышленности и других областях. Они используются в процессе производства металлов, получении керамики, стекла, катализаторов и других веществ. Из-за своей аллотропии, оксиды металлов могут иметь различный электрический и термический проводящий характер, что делает их полезными в электронике и электротехнике.
Исследование аллотропии оксидов металлов имеет большое значение для развития материалов с уникальными свойствами и их применения в различных сферах науки и техники. Изучение структуры и свойств аллотропных соединений способствует разработке новых материалов с оптимальными характеристиками и повышению эффективности их применения.
Аллотропия химических элементов (2 часть):
| 31 | Галлий | Ga | Несколько аллотропных модификаций галлия, из которых устойчивым в условиях окружающей среды является α-галлий |
| 32 | Германий | Ge | 2 аллотропные модификации германия:
— α-германий с кубической алмазной кристаллической решёткой, — β-германий с тетрагональной кристаллической решёткой |
| 33 | Мышьяк | As | 3 аллотропные модификации мышьяка:
— α-мышьяк, серый мышьяк (наиболее распространенная, металлическая модификация) с ромбоэдрической (тригональной) кристаллической решёткой, — β-мышьяк, чёрный мышьяк (неметаллическая модификация) в виде: стеклянной аморфной чёрной формы мышьяка или метастабильной орторомбической чёрной формы мышьяка, — γ-мышьяк, жёлтый мышьяк (неметаллическая модификация) |
| 34 | Селен | Se | Несколько аллотропных модификаций селена, в т.ч.:
— γ-селен, серый кристаллический селен, металлический селен (наиболее устойчивая форма) |
| 35 | Бром | Br | |
| 36 | Криптон | Kr | |
| 37 | Рубидий | Rb | |
| 38 | Стронций | Sr | 3 аллотропные модификации стронция:
— α-стронций с кубической гранецентрированной кристаллической решёткой, — β-стронций с гексагональной кристаллической решёткой, — γ-стронций с кубической объёмно-центрированной кристаллической решёткой |
| 39 | Иттрий | Y | 2 аллотропные модификации иттрия:
— α-иттрий с гексагональной плотноупакованной кристаллической решёткой, — β-иттрий кубической объёмно-центрированной кристаллической решёткой |
| 40 | Цирконий | Zr | 3 аллотропные модификации циркония:
— α-цирконий с гексагональной плотноупакованной кристаллической решёткой, — β-цирконий с кубической объёмно-центрированной кристаллической решёткой, — ω-цирконий с гексагональной кристаллической решёткой |
| 41 | Ниобий | Nb | |
| 42 | Молибден | Mo | |
| 43 | Технеций | Tc | |
| 44 | Рутений | Ru | |
| 45 | Родий | Rh | |
| 46 | Палладий | Pd | |
| 47 | Серебро | Ag | |
| 48 | Кадмий | Cd | |
| 49 | Индий | In | |
| 50 | Олово | Sn | 4 аллотропные модификации олова:
— α-олово, серое олово, с кубической алмазной кристаллической решёткой, — β-олово, белое олово, с тетрагональной объёмно-центрированной кристаллической решёткой, — γ-олово, — σ-олово |
| 51 | Сурьма | Sb | Несколько аллотропных модификаций сурьмы, в т.ч.:
— металлическая сурьма (металлическая форма) – наиболее стабильная форма, — взрывчатая сурьма, — чёрная сурьма, — жёлтая сурьма |
| 52 | Теллур | Te | 2 аллотропные модификации теллура:
— α-теллур (кристаллический, металлический теллур) с гексагональной кристаллической решёткой, — аморфный теллур в виде чёрно-коричневого порошка |
| 53 | Йод | I | |
| 54 | Ксенон | Xe | 2 аллотропные модификации ксенона:
— ксенон с кубической гранецентрированной кристаллической решёткой, — ксенон с гексагональной плотноупакованной кристаллической решёткой |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | 2 аллотропные модификации бария:
— α-барий с кубической объёмно-центрированной кристаллической решёткой, — β-барий |
| 57 | Лантан | La | 3 аллотропные модификации лантана:
— α-лантан с двойной гексагональной плотноупакованной кристаллической решёткой, — β-лантан с кубической гранецентрированной кристаллической решёткой, — γ-лантан с кубической объёмно-центрированной кристаллической решёткой |
| 58 | Церий | Ce | 4 аллотропные модификации церия:
— α-церий с кубической гранецентрированной кристаллической решёткой, — β-церий с двойной гексагональной плотноупакованной кристаллической решёткой, — γ-церий с кубической гранецентрированной кристаллической решёткой, — δ-церий с кубической объемно-центрированной кристаллической решёткой |
| 59 | Празеодим | Pr | 2 аллотропные модификации празеодима:
— α-празеодим с двойной гексагональной плотноупакованной кристаллической решёткой, — β-празеодим с кубической объёмноцентрированной кристаллической решёткой |
| 60 | Неодим | Nd | 2 аллотропные модификации неодима:
— α-неодим с двойной гексагональной плотноупакованной кристаллической решёткой, — β-неодим с кубической объемно-центрированной кристаллической решёткой |
Реорганизация веществ
Продолжаются открытия видов простых материалов, способных к аллотропии, несмотря на то, что список образовательных веществ уже превышает 400 материалов. Типы химических связей в элементарных частицах зависят от строения атома, вместе эти характеристики определяют возможность вещества образовывать разные аллотропные формы.
Компоненты, которые могут изменять показатель координационного числа и стадии окисления, образовывают большее количество аллотропных состояний. Важным фактором разнообразия форм является способность элемента к образованию гомоцепных решеток (состоящих из однотипных атомов).
Преобразование простых элементов
Более выраженными являются аллотропные модификации неметаллов, но среди веществ этой группы имеются исключения, например, благородные газы и галогены. Некоторые состояния отличаются температурной стабильностью, другие характеризуются фазовой динамикой. Такие различия объясняются затратами некоторой энергии при изменении кристаллической решетки в результате плавления.
Примеры реорганизации неметаллов:
- Водород. Может быть в форме пара- и ортоводорода на молекулярном уровне. В первой макромолекуле отмечаются антипараллельные импульсные моменты электронов, а в частицах второго типа проявляются параллельные ядерные спины.
- Углерод. Элемент встречается в виде графена, алмаза, нанотрубок, графита, лонсдейлита и др. Точное количество состояний не поддается учету из-за того, что существует большое многообразие связей атомов друг с другом. Нанотрубки и фуллерены относятся к наиболее многочисленным структурам.
- Фосфор. Вещество насчитывает 11 видов аллотропных форм. Черный, белый и красный фосфор относятся к основным модификациям. Первый вид включается в группу инертных и токопроводящих материалов. Белый фосфор отсвечивает в темноте, ядовит и способен к самостоятельному возгоранию. Красный вид не опасен для человека, не воспламеняется и не светится в сумраке.
- Кислород. В природе бывает в виде озона с ярко выраженным запахом слабо фиолетового цвета или в форме кислорода, который не пахнет и без видимого колера.
- Селен. Представлен в двух видах. Первый — черный селен, второй — серый полимер.
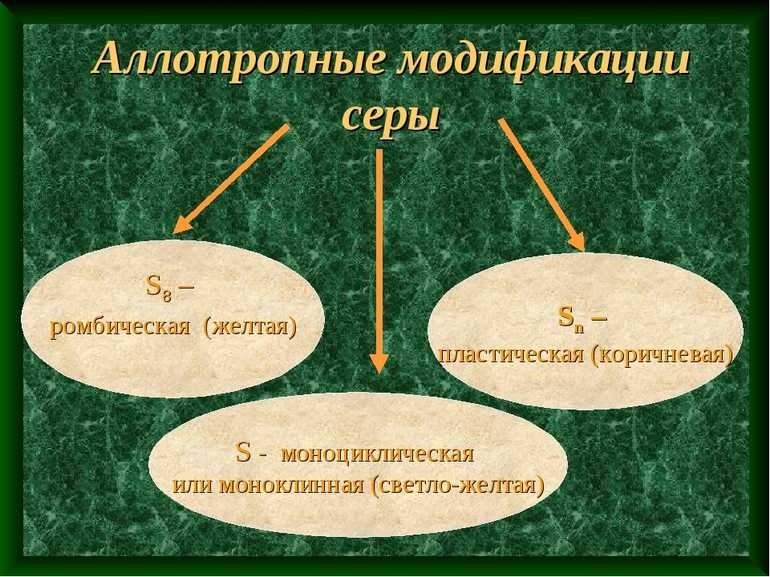
- Сера. По количеству аллотропных состояний находится на 2 месте после углерода. Распространенными видами является моноклинная, пластическая и ромбическая сера.
https://youtube.com/watch?v=C3GSLWfK4x8
Модификации полупроводников
К этой группе относятся элементы, располагающиеся в таблице на переходе от металлов к неметаллам. У материалов присутствует кристаллическая ковалентная решетка, чаще они характеризуются проводимостью по типу металлов. Иногда материалы работают как полупроводники.
Примеры трансформации неметаллов:

- Бор. Существует в природе в кристаллической и аморфной форме, первый тип имеет черный, а второй — бурый колер. Наука знает о более 10 аллотропных состояний бора, которые встречаются в тетрагональном и ромбическом соединении. В некоторых модификациях имеется несколько открытых слоев, образующих бесконечное строение.
- Кремний. Свойства кристаллической формы обусловлены алмазоподобной атомной решеткой, выделяется моно- и поликристаллический кремний. В природе встречается в виде песка, кварцита, полевого шпата, силикатов.
- Мышьяк. Распространены 3 основные аллотропные формы. Серый полимер относится к классу полуметаллов, желтый мышьяк входит в группу неметаллов, черный вид по структуре напоминает красный фосфор.
- Германий. Существует в форме полуметалла с кристаллической решеткой по типу алмаза и в фазе металла с токопроводящими качествами.
- Сурьма. Известно 4 модификации материала в форме металлов, из которых наиболее стабильной является серебристо-белое вещество с голубым оттенком. Аморфные аллотропии существуют в виде желтой, взрывчатой и черной сурьмы.
- Полоний. Находится в 2 металлических разновидностях. Низкотемпературная форма отличается кубическим строением решетки, высокотемпературный вид имеет ромбическую структуру.
К особенностям относится слабое сочетание зоны проводимости и валентной области. Это обеспечивает электропроводность до того времени, пока температура не снизится до 0ºС. Нагревание способствует увеличению электронных дырок (обладателей тока), но видоизменение идет слабо. Положительные квазичастицы в полуметаллах активно двигаются при малой полезной массе. По этой причине материалы больше других веществ подходят для изготовления фазовых переходов в магнитных полях большой силы, наблюдения квантовых и классических размерных эффектов.
Общее понятие
Аллотропия проявляется, благодаря разному составу микрочастиц простой материи и координируется вариантом размещения молекул и атомов в кристаллической решетке. Вещество кристаллизуется в нескольких модификациях, при этом два параметра простой ячейки совпадают. Изменение состояния происходит из-за отличия третьего показателя, который учитывает расстояние между сопредельными слоями.

Явление часто обнаруживается в структурах, которые равнозначны гексагональному и кубическому расположению атомов. Соседняя атомная среда представляет эквивалентное окружение, а различия проявляются на удаленных сферах. Энергетические характеристики решеток приблизительно равны, поэтому физические свойства разных состояний одного элемента остаются похожими.
Первые примеры аллотропных модификаций показал шведский минералог и химик Берцелиус середине XIX века для выделения различных форм нахождения элемента. Через 2 десятка лет была принята гипотеза итальянского химика А. Авогадро о многоатомных молекулах и стало видно, что от строения частиц зависит проявление элемента в материи. Например, О3 — озон, а О2 — кислород.
В 1912 году ученые определили, что различия в структуре простых элементов, например, фосфора или углерода, относятся к первопричинам существования двух и более состояний. В настоящее время аллотропией называется видоизменение простых материй, независимо от агрегатного вида. Изменения в твердых состояниях сложных и простых веществ имеет название полиморфизма. Два определения совпадают, если речь идет о простых материалах в твердом виде (железо, сера в кристаллах, фосфор).
Аллотропия углерода и кремния
Аллотропные формы углерода
Углероду свойственно явление аллотропии. Например, у углерода 4 аллотропные формы: графит, алмаз, карбин, фуллерен. По составу это все тот же углерод, но ввиду особенностей строения молекулы каждого из них, имеются различия в физических и химических свойствах.
Открытие фуллерена произошло относительно недавно, в 1985 г, их особенность в строении молекулы, похожей на футбольный мяч. Наиболее распространены молекулы фуллерена С60, состоящего из 60 атомов углерода,и фуллерена С70, состоящего из 70 атомов углерода.
Благодаря своему строению, обладает уникальными свойствами, который открывает широкий спектр применений. Начиная применениями в физике, заканчивая медициной. Молекула является мощнейшим антиоксидантом, используемая даже в борьбе с ВИЧ.
Аллотропные модификации углерода Источник
Графит и алмаз нам хорошо знакомы. Первый используется как грифель для простого карандаша, второй является драгоценным камнем, но ввиду своей прочности используется и в строительстве, и в медицине и т.д. Отличны они по своим физическим свойствам, в силу различий строений графических решеток.
Графит вещество темно-серого цвета, не поддается плавлению, обладает металлическим блеском и достаточно мягкий. Его кристаллическая решетка атомная. Это означает, что в узлах таких решеток атомы, связаны ковалентной полярной или неполярной связью. Такая кристаллическая решетка влияет и на свойства вещества, придавая тугоплавкость, нерастворимость в воде.
Изображение графита при нахождении в природе и графит в грифеле карандаша.
Алмаз – самое твердое вещество на земле. Цвета не имеет.Плавлению не поддается. Высока твердость и тугоплавкость алмаза объясняется строением кристаллической решетки.Связи между атомами углерода – ковалентные неполярные, они равны по длине и энергии. Поэтому сложно разорвать их. Иначе называют «кубической аллотропной формой углерода».
Алмазы до и после огранки
Карбин — это еще одна аллотропная модификация углерода, по последним данным это вещество считается тверже алмаза.Было впервые получено и открыто в 1960-х годах. Примечательно, что сначала его получили в лаборатории, а после обнаружили в природе, в виде вкраплений в чаоите (минерал белого цвета, называемый иначе «белый углерод»), графите и в метеоритах.Обладает широкими набором свойств. В обычном состоянии порошкообразное вещество. Также тугоплавкое.
Чаоит
Аллотропия кремния
Аллотропия кремния выражена двумя видами кремния: аморфным и кристаллическим. Это два вещества,одинаковых по составу, но различные построению молекул. Эти отличия наделяют их разными физическими и химическими свойствами, а также различиями во внешнем виде.
Цвет кристаллического кремния темный, почти черный. Присутствует металлический блеск. Твердый на ощупь, при этом хрупкий. Обладает свойствами полупроводником. Полупроводники – вещества, способные проводить электричество. Но по своей способности проводить последнее они находятся между проводниками, хорошо проводящими электрический ток, и диэлектриками, веществами, плохо проводящими электрический ток.
Кипит и плавится при больших температурах, реакционно не активен. Структуру имеет подобную алмазу.
Аморфный кремний буро-красный по цвету, порошкообразен. Хорошо впитывает воду, но структура такая же как у кристаллического.
Аллотропия кремния
Свойства углерода и кремния
Химические свойства углерода
Для углерода нередко характерны разные степени окисления. Но самые распространённые степени окисления: +4, +2. Мало реакционноспособен углерод при комнатной температуре. Но нагревание увеличивает реакционную способность и углерод взаимодействует с некоторыми металлами и кислотами, а также с кислородом, азотом, галогенами и водородом.
Однако для углерода характерны реакции, в которых он проявляет восстановительные и окислительные свойства.



Химические свойства кремния
Неметалл, мало реакционноспособен. Характерные степени окисления: от -4 до +4. Элемент, очень распространенный в земной коре, уступает первенство лишь кислороду. Значительное распространение получил именно оксид этого элемента, входя состав разных пород, а главное песка, кварца и глины. Большое значение имеет в жизни человека, т.к. из оксида делают стекло, цемент. В чистом виде представляется в виде минерала – горного хрусталя. Так же входит в состав драгоценных и полудрагоценных камней.
Особое внимание уделяется влиянию кремния на свойства стали. Кремний, при добавлении к стали, изменяет атомную решетку железа (сталь состоит из железа, углерода и других элементов)
Это влияет на свойства стали: увеличиваются магнитная проницаемость, упругость и сопротивляемость к коррозии, прочность.



Оксид углерода (II) СО
Называемый иначе угарным газом. Вещество бесцветное, не имеющее запаха. В мире часто происходят отравления угарным газом животных и людей.В воде не растворяется, но в органических растворителях, напротив, хорошо растворимо t°кип = -192°C; t пл = -205°C.
Известны два вида получения. В промышленности и лабораторных условиях. Первый необходим для получения в больших объёмах, ведь данный газ активно используется в химической промышленности как сырье для синтеза других веществ, на основе углерода.

Свойства оксида. При обычных условиях CO мало активен. При повышении температуры вступает в реакцию. Солей не образует.
Химические свойства:


Оксид углерода (IV) СO2
Более известен как углекислый газ. Не имеющий цвета и запаха. Превышает массу воздуха. Температура t°пл= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение (вступает в реакцию с кислородом, что делает невозможным горение). Распространён повсеместно. Очень значим в природе.
Получение

Свойства (углекислого газа) СO2
Углекислый газ — кислотный оксид,реагирует с основными оксидами и основаниями, образуя соли угольной кислоты. Качественной реакцией (реакция для обнаружения вещества) является помутнение известковой воды.

Так как оксид обладает свойством предотвращать горение,его используют в противопожарных условиях. А также углекислый газ используют при изготовлении газированных напитков.
Применение аллотропии металлов
Аллотропия металлов, то есть способность металлов существовать в различных структурных формах, находит широкое применение в различных областях науки и техники. Это явление позволяет получить материалы с различными физическими и химическими свойствами, а также расширяет возможности их использования.
Одно из применений аллотропии металлов связано с созданием сплавов. Изменение структуры металла позволяет получить сплавы с различными свойствами, такими как прочность, твердость и устойчивость к коррозии. Примером такого применения является сталь, которая является сплавом железа с различными примесями. Разные типы стали имеют различную структуру, что определяет их свойства и области применения.
Также аллотропия металлов используется в процессе получения полупроводников. Некоторые металлы, такие как кремний и германий, могут образовывать различные аллотропные модификации, которые обладают полупроводническими свойствами. Это позволяет использовать такие материалы в электронике для создания полупроводниковых компонентов, таких как диоды и транзисторы.
Кроме того, аллотропия металлов находит применение в области катализа. Некоторые аллотропные формы металлов обладают специфическими каталитическими свойствами, которые позволяют использовать их в процессе химических реакций. Такая катализаторная активность металлов может быть связана с их особой структурой или поверхностными особенностями, что делает их эффективными и экономически выгодными для промышленного производства различных химических веществ.
Таким образом, аллотропия металлов имеет многочисленные практические применения, от создания сплавов с определенными свойствами до использования аллотропных форм металлов в качестве катализаторов или полупроводников. Изучение аллотропии металлов позволяет расширить наши знания о структуре и свойствах материалов, а также разработать новые технологии и материалы, которые могут быть использованы в различных отраслях промышленности и науки.
Углерод и кремний
Строение углерода. Углерод представитель четвертой группы, главной подгруппы. Обозначение в периодической системе – С. Находится он, в системе элементов под номером 6, атомный вес равен 12. Заряд ядра +6. Внешний слой представлен 4 электронами, двумя спаренными s-электронами и двумя неспаренным и р-электронам.
Имеет множество интересных особенностей в своем строении. Элемент поистине уникальный. Называют его «царём органического мира». И за его особенности строения молекулы и атома, он может образовывать множество элементов. А в химии есть целый раздел, изучающий эти соединения.
группы, главной подгруппы.Но в отличие от углерода он в третьем периоде. Что наделяет его несколько иными свойствами.
Кремний также называют «царем», но только неорганического «мира». Если органическим миром называют совокупность живых организмов их продукты жизнедеятельности. То неорганической называют природу неживую. И ее главное отличие – не способность гореть в огне.
Кремний так же образует множество соединений (второй по распространению в земной породе элемент после кислорода). Состав земной породы можно описать так: соединения кремния и кислорода с другими элементами. Химический знак — Si. Порядковый номер – 14, заряд ядра +14. В свободной форме вещество имеет металлический блеск.
Внешний слой атома кремния такой же, как внешний слой атома углерода. Так же 4 атома, но разница в радиусе, расстоянии до ядра. Оно больше, чем у углерода, а значит атомы менее связаны с ядром.
Нахождение кремния в природе в виде минералов Источник
Строение атома кремния Источник
Применение аллотропии в промышленности
Аллотропия металла – это явление изменения структурной формы металла при изменении условий его окружающей среды, таких как температура или давление. Это свойство нашло широкое применение в промышленности, где аллотропные модификации металлов используются для создания различных материалов и изделий.
Одним из примеров применения аллотропии металла является использование железа. При комнатной температуре железо находится в аллотропной модификации – феррите. Однако при высоких температурах железо претерпевает превращение и переходит в другую модификацию – аустенит. Использование этой особенности позволяет производить сталь, которая обладает различными свойствами в зависимости от температуры, и становится более прочной и удобной для обработки.
Другим примером применения аллотропии является использование титана. Титан находится в двух аллотропных модификациях: альфа-тип и бета-тип. Альфа-тип обладает низкой прочностью, но хорошо поддается обработке, поэтому его используют при производстве различных изделий. Бета-тип титана, напротив, обладает высокой прочностью, и поэтому находит свое применение в авиационной и космической отрасли, где требуется высокая прочность материала.
Также аллотропия находит применение в производстве различных сплавов. К примеру, латунь – это сплав меди и цинка, который при изменении соотношения этих компонентов может иметь различные свойства, например, устойчивость к коррозии или хорошую обрабатываемость. Этот пример демонстрирует, как аллотропия металла может использоваться для создания материалов с различными химическими и физическими свойствами в зависимости от нужд конкретной промышленности.
Распространенность аллотропии металлов в природе
Аллотропия металлов является явлением, при котором металлы могут образовывать различные аллотропные модификации. Это означает, что один и тот же металл может существовать в различных кристаллических структурах или фазах, имеющих различные свойства и характеристики.
Такое явление встречается в природе достаточно часто. Например, самым известным примером аллотропии металла является железо. Оно существует в двух основных аллотропных модификациях — α-железо и γ-железо. При комнатной температуре α-железо является стабильной формой железа, однако при температурах выше 910°C оно превращается в γ-железо.
Кроме железа, аллотропия также распространена у других металлов. Например, у меди существуют две аллотропные модификации — α-медь и γ-медь. Аллотропия также характерна для олова, свинца, никеля и титана.
Интересно отметить, что аллотропные модификации металлов могут иметь различные свойства и применения. Например, аллотропная модификация олова — оловянная медь, обладает лучшей плотностью и прочностью, чем обычное олово, поэтому она широко используется в электронике и производстве полупроводников.
В целом, аллотропия металлов является важным явлением, которое определяет свойства и применение многих металлических материалов. Изучение аллотропных модификаций помогает лучше понять и описать поведение металлов в различных условиях и применениях.
Некоторые химические элементы и их модификации
Неметаллы
- Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие.
- Сера — вторая по подверженности аллотропии среди неметаллов. Основные ее виды: ромбическая, моноклинная и пластическая. При нормальных условиях окружающей среды моноклинная и пластическая модификации серы переходят в ромбическую.
- Фосфор — имеет 11 аллотропных форм, различающихся числом атомов в молекуле, химическими связями и свойствами, из которых белый фосфор, красный фосфор и черный фосфор имеют устойчивые формы и встречаются в природе, остальные формы распадающиеся и в природе не встречаются.
- Селен — в свободном состоянии бывает в трех видах: красный цикло-Se8, гексагональный или серый селен Se и чёрный селен.
- Водород — бывает в виде o-H2 (орто-водород) и p-H2 (пара-водорода). Молекулы o-H2 и p-H2 отличаются построением ядерных спинов. У o-H2 они параллельные, у p-H2 антипараллельные.
- Кислород — модифицируется в два вещества: Кислород (O2) и Озон (O3).
Полуметаллы
- Бор — встречается в более, чем в 10 состояниях в аморфной и кристаллической формах. Физические свойства этих форм различны.
- Кремний — бывает в аморфной и кристаллической формах. У кристаллической модификации решётка атомная, алмазоподобная.
- Сурьма — имеет четыре металлические и три аморфные аллотропные модификации. Металлические формы существуют при разном давлении. Аморфные формы сурьмы: взрывчатая, чёрная и жёлтая.
- Мышьяк — встречается в трех аллотропных состояниях: в виде неметалла или жёлтый мышьяк, в виде полуметаллического полимера или серый мышьяк, в виде неметаллической молекулярной структуры или чёрный мышьяк.
Металлы
-
Железо — бывает в виде четырех кристаллических модификаций:
- α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;
- β-Fe. Имеет решётку объемноцентрированную кубическую. Существует при температурах от 769 °C до 917 °C. Обладает магнитными свойствами парамагнетики;
- γ-Fe или аустенит. Имеет решётку гранецентрированную кубическую. Существует при температурах от 917 °C до 1394 °C;
- δ-Fe. Имеет решётку объемноцентрированную кубическую. Имеет устойчивость при температуре выше 1394 °C.
- Олово — имеет две аллотропные формы: серое олово (α-Sn) с алмазоподобной кристаллической решёткой в виде мелкокристаллического порошка и белое олово (β-Sn) в виде пластичного серебристого металла, а также одну аллотропическую модификацию гамма-олово (γ-Sn) с ромбической структурой. Оно высокотемпературное.






























