Смеси и растворы
Раствор
– однородная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах.
Раствор:
растворитель (например, вода) + растворенное вещество.
Истинные растворы
содержат частицы размером менее 1 нанометра.
Коллоидные растворы
содержат частицы размером 1-100 нанометра.
Механические смеси
(взвеси) содержат частицы размером более 100 нанометра.
Суспензия
=> твердое + жидкое
Эмульсия
=> жидкое + жидкое
Пена, туман
=> газ + жидкое
Неоднородные смеси разделяют
отстаиванием и фильтрованием.
Однородные смеси разделяют
выпариванием, дистилляцией, хроматографией.
Насыщенный раствор
находится или может находиться в равновесии с растворяемым веществом (если растворяемое вещество – твердое, то его избыток – в осадке).
Растворимость
– содержание растворенного вещества в насыщенном растворе при данной температуре.
Ненасыщенный раствор
меньше,
Пересыщенный раствор
содержит растворенного вещества больше,
чем его растворимость при данной температуре.
Массовая доля растворенного вещества
w(B);
Где т(В)
– масса В,
т(р)
– масса раствора.
Масса раствора,
m(p), г:
m(p) = m(B) + m(H 2 O) = V(p) ρ(p),
ρ(p) – плотность раствора.
Объем раствора, V(p),
л:
Молярная концентрация,
Где n(В) – количество вещества В;
М(В) – молярная масса вещества В.
Изменение состава раствора
Разбавление раствора водой:
> т»(В)
= т(В);
> масса раствора увеличивается на массу добавленной воды: m»(p) = m(p) + m(H 2 O).
Выпаривание воды из раствора:
> масса растворенного вещества не изменяется: т»(В) = т(В).
> масса раствора уменьшается на массу выпаренной воды: m»(p) = m(p) – m(H 2 O).
Сливание двух растворов:
массы растворов, а также массы растворенного вещества складываются:
т»(В) = т(В) + т»(В);
т»(р) = т(р) + т»(р).
Выпадение кристаллов:
масса растворенного вещества и масса раствора уменьшается на массу выпавших кристаллов:
m»(В) = m(В) – m(осадка); m»(р) = m(р) – m(осадка).
Масса воды не изменяется.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe, Cuprum – Cu, Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
|
Сведения |
На примере Cl |
| Название элемента | Хлор |
| Принадлежность элемента к данному классу химических элементов | Неметалл, галоген |
| Один атом элемента | 1 атом хлора |
| Относительная атомная масса (Ar) данного элемента | Ar(Cl) = 35,5 |
|
Абсолютная атомная масса химического элемента
m = Ar · 1,66·10-24г = Ar · 1,66 · 10-27кг |
M(Cl) = 35,5 · 1,66 · 10-24 = 58,9 · 10-24г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак |
Название химического знака
(произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля | Безразмерная | |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль |

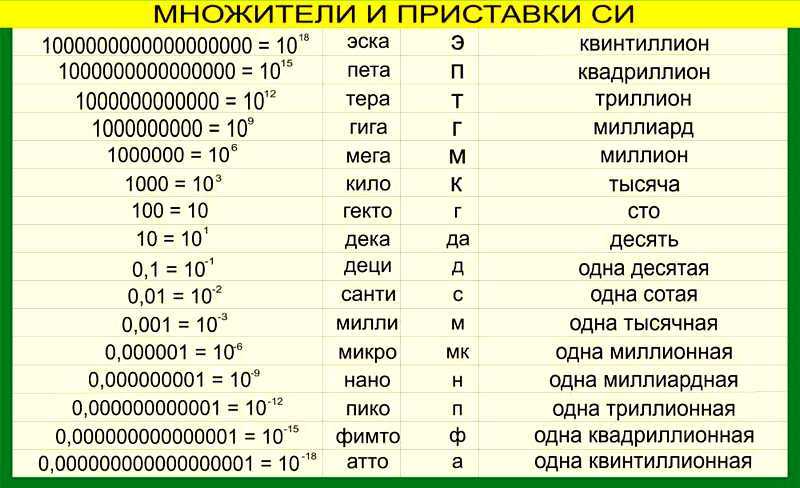
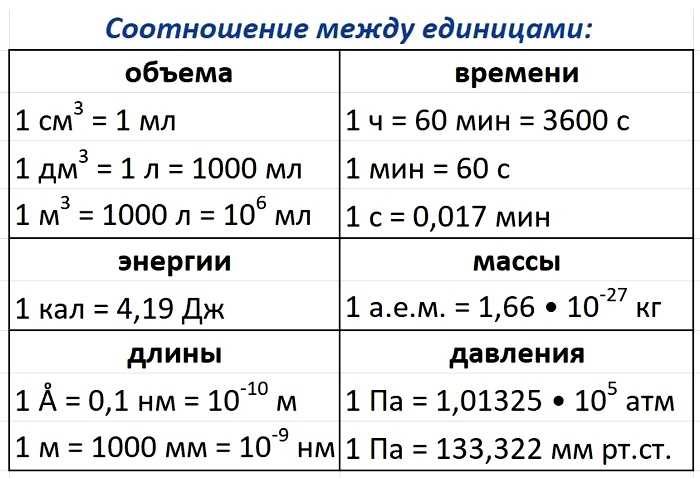

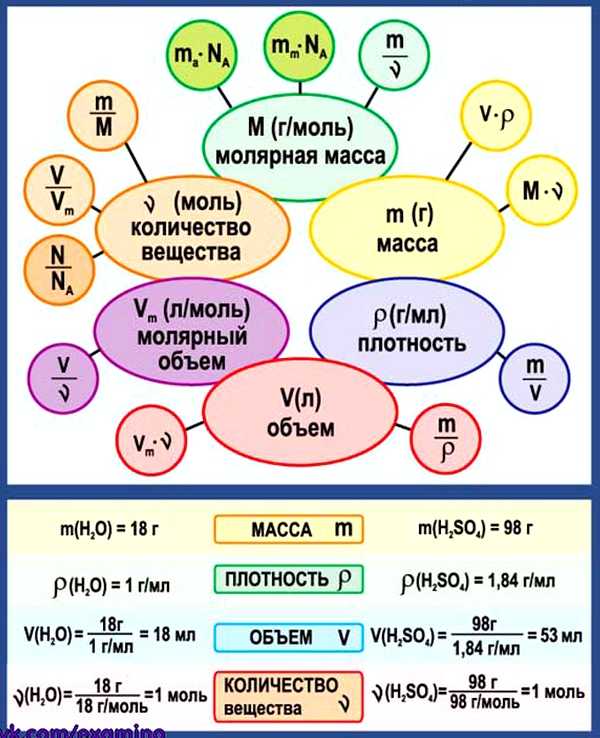
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ 1. Существуют вещества с молекулярным и немолекулярным строением. 2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. 3. Молекулы находятся в непрерывном движении. 4. Молекулы состоят из атомов. 6. Атомы характеризуются определённой массой и размерами. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

ХИМИЧЕСКАЯ РЕАКЦИЯ Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.Признаки химических реакций: 1. Выделение теплоты (света). 2. Изменение окраски. 3. Появление запаха. 4. Образование осадка. 5. Выделение газа.
Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.

Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Так вещество железо и химический элемент железо обозначаются одинаково – Fe.
Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H2, O2, O3, N2, F2, Cl2, Br2, P4, S8.
Таблица 3: Информация, которую дает химический знак
|
Сведения |
На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar(C) = 12 |
| Абсолютная атомная масса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10-24г |
| Один моль вещества | 1 моль углерода, т.е. 6,02 · 1023 атомов углерода |
| Молярная масса вещества | M(C) = Ar(C) = 12 г/моль |
Уроки
Введение
Активные металлыNEW
+ тестирование
+ тестирование
Закон постоянства состава веществаNEW
+ тестирование
+ тестирование
Закон сохранения массы веществNEW
+ тестирование
+ тестирование
Значение периодического закона МенделееваNEW
+ тестирование
+ тестирование
Названия химических элементовNEW
+ тестирование
+ тестирование
Относительная атомная и молекулярная массыNEW
+ тестирование
+ тестирование
Относительная молекулярная массаNEW
+ тестирование
+ тестирование
Периодический закон МенделееваNEW
+ тестирование
+ тестирование
Химический элементNEW
+ тестирование
+ тестирование
Химия в жизни человекаNEW
+ тестирование
+ тестирование
Атомы химических элементов
Валентность химических элементовNEW
+ тестирование
+ тестирование
Валентность химических элементовNEW
+ тестирование
+ тестирование
Образование химических элементов и веществNEW
+ тестирование
+ тестирование
Строение атомаNEW
+ тестирование
+ тестирование
Строение атома азотаNEW
+ тестирование
+ тестирование
Строение атома алюминияNEW
+ тестирование
+ тестирование
Строение атома кальцияNEW
+ тестирование
+ тестирование
Строение атома кислородаNEW
+ тестирование
+ тестирование
Строение атома кремнияNEW
+ тестирование
+ тестирование
Строение атома серыNEW
+ тестирование
+ тестирование
Строение электронных оболочек атомовNEW
+ тестирование
+ тестирование
Схемы образования химических элементовNEW
+ тестирование
+ тестирование
Таблица валентности химических элементовNEW
+ тестирование
+ тестирование
Таблица окисления химических элементовNEW
+ тестирование
+ тестирование
Таблица электроотрицательности химических элементовNEW
+ тестирование
+ тестирование
Электронные формулы химических элементовNEW
+ тестирование
+ тестирование
Простые вещества
Cвойства аммиакаNEW
+ тестирование
+ тестирование
Закон АвогадроNEW
+ тестирование
+ тестирование
Круговорот азота в природеNEW
+ тестирование
+ тестирование
Молярная массаNEW
+ тестирование
+ тестирование
Молярный объемNEW
+ тестирование
+ тестирование
Молярный объем газаNEW
+ тестирование
+ тестирование
Свойства азотаNEW
+ тестирование
+ тестирование
Свойства металловNEW
+ тестирование
+ тестирование
Состав воздухаNEW
+ тестирование
+ тестирование
Строение металловNEW
+ тестирование
+ тестирование
Физические свойства водородаNEW
+ тестирование
+ тестирование
Характеристика элемента кремнияNEW
+ тестирование
+ тестирование
Химические свойства водородаNEW
+ тестирование
+ тестирование
Химические свойства кислородаNEW
+ тестирование
+ тестирование
Соединения химических элементов
Гидроксид кальцияNEW
+ тестирование
+ тестирование
Гидроксид кремнияNEW
+ тестирование
+ тестирование
Кислотные оксидыNEW
+ тестирование
+ тестирование
Классификация неорганических веществNEW
+ тестирование
+ тестирование
Общие химические свойства солейNEW
+ тестирование
+ тестирование
Оксид кальцияNEW
+ тестирование
+ тестирование
Оксид кремнияNEW
+ тестирование
+ тестирование
ОснованияNEW
+ тестирование
+ тестирование
Основные оксидыNEW
+ тестирование
+ тестирование
Таблица окисления химических элементовNEW
+ тестирование
+ тестирование
Углекислый газNEW
+ тестирование
+ тестирование
Химические свойства кислотных оксидовNEW
+ тестирование
+ тестирование
Химические свойства солейNEW
+ тестирование
+ тестирование
Чистые вещества и смесиNEW
+ тестирование
+ тестирование
Чистые вещества и смесиNEW
+ тестирование
+ тестирование
Изменения, происходящие с веществами
Реакция нейтрализацииNEW
+ тестирование
+ тестирование
Скорость химической реакцииNEW
+ тестирование
+ тестирование
Уравнения химических реакцийNEW
+ тестирование
+ тестирование
Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции
Генетическая связь между классами веществNEW
+ тестирование
+ тестирование
Классификация кислотNEW
+ тестирование
+ тестирование
Константа диссоциацииNEW
+ тестирование
+ тестирование
Свойства кислотNEW
+ тестирование
+ тестирование
Сильные электролитыNEW
+ тестирование
+ тестирование
Слабые электролитыNEW
+ тестирование
+ тестирование
Химические свойства кислотNEW
+ тестирование
+ тестирование
ЭлектролитNEW
+ тестирование
+ тестирование
Электролитическая диссоциацияNEW
+ тестирование
+ тестирование
Свойства электролитов (химический практикум)
Сильные и слабые электролитыNEW
+ тестирование
+ тестирование
Электрический ток в электролитахNEW
+ тестирование
+ тестирование
Основные свойства простых неорганических веществ
Металлы:
- имеют металлический блеск;
- находятся в твёрдом агрегатном состоянии (кроме жидкой ртути Hg);
- обладают тепло- и электропроводностью;
- прочные, пластичные и ковкие (за исключением хрупких: марганец Mn, висмут V, сурьма Sb, кобальт Co, хром Cr);
- в химических реакциях металлы обычно восстановители (легко отдают свои электроны);
- вытесняют водород из кислот.
Неметаллы — химические элементы, не обладающие металлическими свойствами:
Амфотерные вещества проявляют и металлические (оснóвные), и неметаллические (кислотные) свойства: бериллий Be, алюминий Al, свинец Pb, цинк Zn, железо Fe, марганец Mn и другие.
Благородные (инертные) газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
- входят в состав воздуха (кроме Rn);
- не имеют цвета, вкуса и запаха;
- вступают в реакции с другими веществами только в специально созданных условиях;
- лучше, чем другие газы, проводят электрический ток, при этом светятся: неон — оранжевый, криптон — зелёный, ксенон — фиолетовый и др.
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.

Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
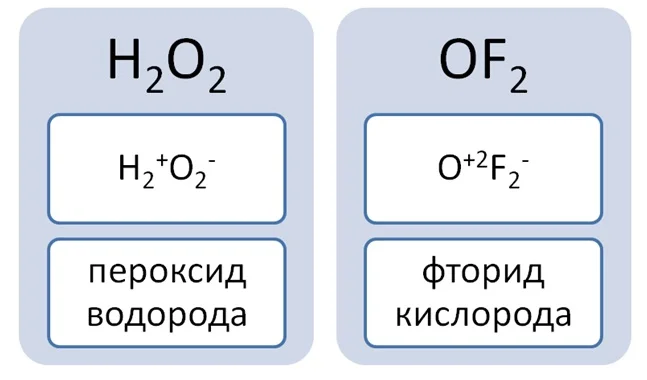
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды
При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида
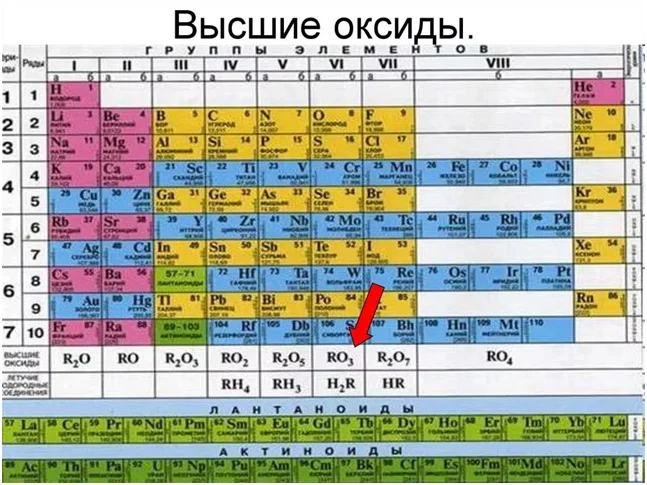
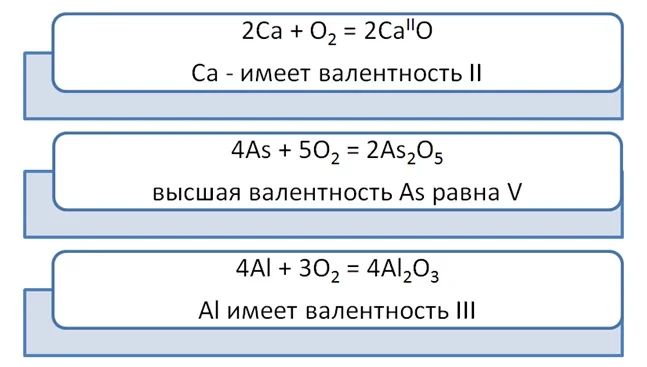
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.

Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
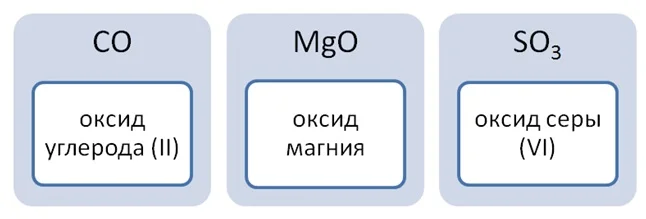
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
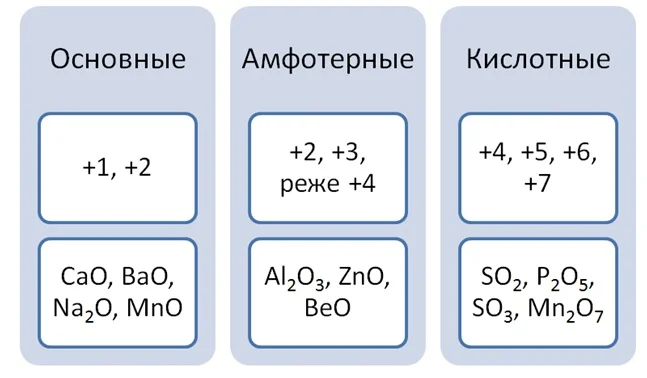
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
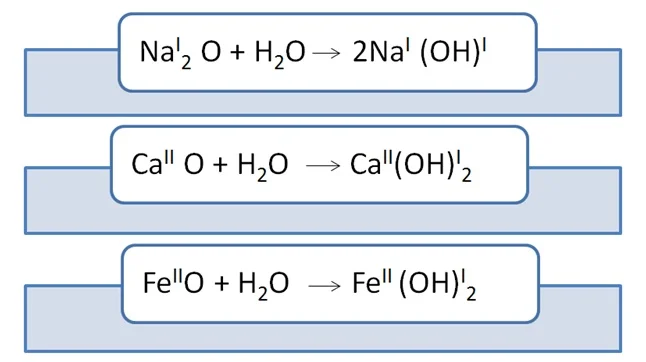
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции — соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
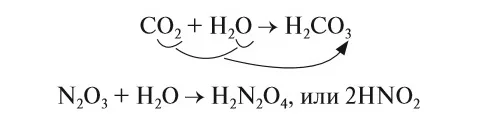
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
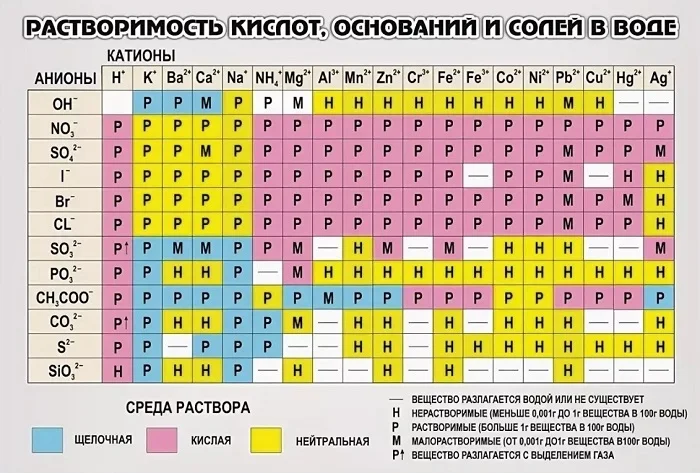
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
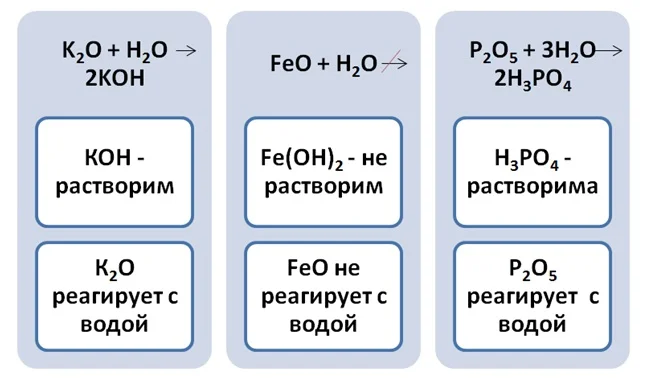
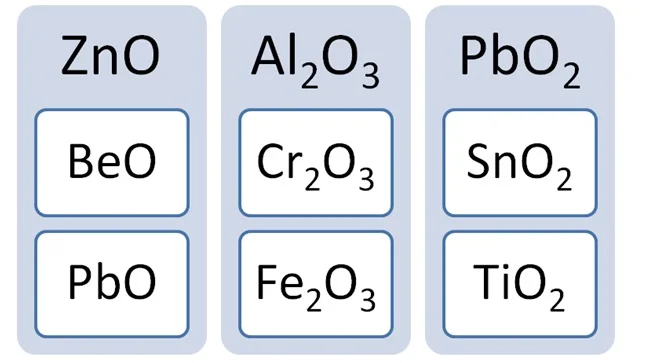
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Примеры решения задач
ПРИМЕР 1
| Задание | При полном сгорании кислородсодержащего органического вещества массой 13,8 г получили 26,4 г углекислого газа и 16,2 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 23. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у» и «z» соответственно:
C x H y O z + O z →CO 2 + H 2 O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO 2)×M(C) = ×M(C); m(H) = n(H)×M(H) = 2×n(H 2 O)×M(H) = ×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO 2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H 2 O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. m(C) = ×12 = 7,2 г; m(H) = 2×16,2 / 18 ×1= 1,8 г. m(O) = m(C x H y O z) — m(C) — m(H) = 13,8 — 7,2 — 1,8 = 4,8 г. Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z = 7,2/12:1,8/1:4,8/16; x:y:z = 0,6: 1,8: 0,3 = 2: 6: 1. Значит простейшая формула соединения C 2 H 6 O и молярную массу 46 г/моль . Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: M substance = M(H 2) × D(H 2) ; M substance = 2 × 23 = 46 г/моль. M substance / M(C 2 H 6 O) = 46 / 46 = 1. Значит формула органического соединения будет иметь вид C 2 H 6 O. |
| Ответ | C 2 H 6 O |
ПРИМЕР 2
| Задание | Массовая доля фосфора в одном из его оксидов равна 56,4%. Плотность паров оксида по воздуху равна 7,59. Установите молекулярную формулу оксида. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Вычислим массовую долю кислорода в соединении: ω (O) = 100% — ω(P) = 100% — 56,4% = 43,6%. Обозначим количество моль элементов, входящих в состав соединения за «х» (фосфор), «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(P)/Ar(P) : ω(O)/Ar(O); x:y = 56,4/31: 43,6/16; x:y = 1,82: 2,725 = 1: 1,5 = 2: 3. Значит простейшая формула соединения фосфора с кислородом будет иметь вид P 2 O 3 и молярную массу 94 г/моль . Значение молярной массы органического вещества можно определить при помощи его плотности по воздуху: M substance = M air × D air; M substance = 29 × 7,59 = 220 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: M substance / M(P 2 O 3) = 220 / 94 = 2. Значит индексы атомов фосфора и кислорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид P 4 O 6 . |
| Ответ | P 4 O 6 |
Основные свойства сложных неорганических веществ
Оксиды — соединения двух химических элементов, один из которых — кислород.
Оксиды:
По химическим характеристикам оксиды подразделяют на:
- Несолеобразующие — (им не соответствуют кислоты).
- Солеобразующие:
Основания — соединения катиона металла (амфотерного элемента или иона ) и гидроксид-аниона -OH.
Основания:
Изменяют окраску индикаторов:
- фенолфталеин (бесцветный) → малиновый;
- метиловый оранжевый → жёлтый;
- лакмус фиолетовый → синий.
В зависимости от отношения к воде основания подразделяют на:
Кислоты — соединения анионов кислотных остатков с катионами водорода, которые могут замещаться на катионы металлов.
Кислоты:
Меняют цвет индикаторов:
- метиловый оранжевый → розовый;
- лакмус фиолетовый → красный;
- фенолфталеин остаётся бесцветным.
Соли — соединения одного или нескольких катионов (или подобных ионов, например, и анионов кислотного остатка (одного или нескольких).
Соли:
ГДЗ по химии для 8 класса О.С. Габриелян
Химия – это довольно увлекательная и обширная наука. Именно она помогла людям научиться получать различные материалы и превращать одно вещество в совершенно иное. Умело пользоваться дарами природы, применяя их в современной промышленности, научила нас химия. И яркий пример тому, это производство различных лекарств, которые постоянно спасают жизни громадному количеству людей.
И в 8 классе школьникам предстоит познакомиться с этим увлекательным предметом и заготовить прочную базу, на которой будут строиться знания в будущем. А верным помощником и надежным товарищем в этом вопросе для восьмиклассников станет О.С. Габриелян. Заслуженный педагог и специалист своего дела он написал решебник к школьному учебнику по химии 8 класса.
Сборник ГДЗ является неотъемлемой частью учебно-методического комплекса по химии, разработанного для учеников общеобразовательной школы. Готовые ответы призваны помочь восьмикласснику разобраться со сложными терминами и понятиями , ответить на все вопросы из сорока пяти параграфов и научить правильно оформлять лабораторные и практические работы.
Вначале ГДЗ по химии за 8 класс Габриелян предоставят основные химические понятия. И с первой главы уже начнется изучение атомов всех химических элементов. Далее пойдут темы о простых веществах и о соединениях химических элементов. Четвертая глава расскажет про изменения, происходящие с некоторыми веществами. И самая обширная последняя глава включает информацию про растворение, растворы и про реакции ионного обмена и окислительно-восстановительных реакциях.
Включили в сборник авторы и готовые ответы к химическим практикумам № 1 и 2 . Первый представляет алгоритмы решения практических работ, в основе которых лежат простейшие операции с веществом. А именно, школьникам предстоит наблюдать за изменениями, происходящими с горящей свечей, они должны будут проанализировать свойства почвы и воды. Расписать признаки химических реакций и рассчитать массовую долю сахара в растворе также предстоит восьмиклассникам при заполнении первого практикума.
Второй практикум посвящен свойствам электролитов. Поэтому его работы будут заключаться в определении ионной реакции; реакций между растворами электролитов; свойств кислот, оснований, оксидов и солей, а также необходимо будет решить экспериментальные задачи. В конце пособия представлены ответы к лабораторным опытам.
ГДЗ к рабочей тетради по химии за 8 класс Габриелян О.С. можно скачать
здесь.
ГДЗ к тетради для оценки качества знаний по химии за 8 класс Габриелян О.С. можно скачать
здесь.
Формулы химических веществ
Формулы веществ также указывают не только состав вещества, но и его количество и массу. Каждая формула изображает или одну молекулу вещества, или один моль вещества, или массу вещества, равную (или пропорциональную) его молярной массе. Например, H 2 O обозначает или одну молекулу воды, или один моль воды, или 18 единиц массы (обычно (18 г) воды.
Простые вещества также обозначаются формулами, показывающими, из скольких атомов состоит молекула простого вещества: например, формула водорода H 2 . Если атомный состав молекулы простого вещества точно не известен или вещество состоит из молекул, содержащих различное число атомов, а также, если оно имеет не молекулярное, а атомное или металлическое строение, простое вещество обозначают символом элемента. Например, простое вещество фосфор обозначают формулой P, поскольку в зависимости от условий фосфор может состоять из молекул с различным числом атомов или иметь полимерное строение.






























